В конце XIX века английский врач Гюнтер, изучая ряд заболеваний внутренних органов, обратил внимание на нездоровый цвет лица его больных, наличие у них неврозов, анемии, расстройств пищеварения. При этом Гюнтер выявил, что у всех больных в полости рта имелись зубы с некротизированной пульпой. После удаления таких зубов у большинства больных наступило значительное улучшение самочувствия или выздоровление. В 1910 г. Гюнтер сформулировал понятие об очаговой инфекции полости рта и ротовом сепсисе, которое получило быстрое распространение за рубежом и имело много сторонников. Гюнтер призывал удалять все зубы с некротизированной пульпой, так как считал, что лечение таких зубов «консервирует в них инфекцию».
В начале XX века в работах американских ученых Биллингса и Розенау была предложена доктрина ротового сепсиса. Основные положения этой доктрины были следующими. Микроорганизмы стрептостафилококковой группы могут значительно изменять свою вирулентность в зависимости от условий внешней среды и особенно от содержания в ней кислорода. Кроме этого, патогенные микроорганизмы обладают феноменом избирательной локализации, то есть микробы из очага одонтогенной инфекции способны проникать через ток крови и поражать различные внутренние органы и ткани, по отношению к которым они обладают определенным сродством. Отсюда следовал вывод, что любой зуб с некротизированной пульпой подлежит обязательному удалению.
Практическим результатом этой доктрины явилось массовое удаление зубов с хроническими периапикальными очагами одонтогенной инфекции и некрозом пульпы. Такой упрощенный подход к решению сложных клинических вопросов устранял необходимость какой-либо дифференциальной диагностики этих очагов инфекции и выбора метода их лечения.
В Европе на основании экспериментальных работ стоматологов, терапевтов, бактериологов и других специалистов доктрина ротового сепсиса подверглась в более поздние годы резкой критике, так как были получены новые данные и вскрыт ряд методических ошибок в экспериментах, проведенных Биллингсом и Розенау.
В СССР вопрос о хронической стоматогенной очаговой инфекции и сенсибилизации организма впервые глубоко освещался в 1925 г. на II Всесоюзном одонтологическом съезде. Отечественные ученые С. С. Стериопуло, Я. С. Пеккер, Н. А. Астахов, Д. А. Энтин и другие дали критическую оценку доктрине ротового сепсиса, феномену избирательной локализации микроорганизмов и высказали собственные научные представления о взаимосвязи между хроническим очагом инфекции и заболеваниями внутренних органов с учетом сенсибилизации организма человека, состояния его нервной системы и иммунитета. В результате проведенных исследований были разработаны новые методы консервативного лечения. Были также пересмотрены известные методы лечения, направленные на сохранение зубов. Однако патогенетическая роль хронических одонтогенных очагов инфекции в возникновении патологии внутренних органов сомнений ни у кого не вызывала.
Учение о хронической стоматогенной инфекции и сенсибилизации организма имело большое и важное значение в развитии стоматологии, внесло определенный вклад в развитие всей современной клинической медицины и остается актуальным и в настоящее время.
Ведущее место в этиологии хронических очагов одонтогенной инфекции занимает микробный фактор. Выделяемые из одонтогенных очагов инфекции микробы представляют собой ассоциации стрептококков, стафилококков, грамположительных и грамотрицательных палочек, спиралевидных форм бактерий. Реже высеваются монокультуры.
В последние годы раскрыты многие механизмы хронизации острых инфекционных одонтогенных процессов, чаще верхушечных периодонтитов. Сущность этих механизмов заключается в том, что в период острого воспаления в периодонте накапливаются антигены, среди которых основную роль играют эндотоксины грамотрицательных микроорганизмов. Эндотоксины оказывают сильное антигенное воздействие на иммунное состояние периодонта и окружающих его тканей (Ю. М. Максимовский, 1996). Реакция тканей периодонта на непрерывное раздражение антигенами, поступающими из канала корня зуба, проявляется в виде антигенозависимых и клеточно-обусловленных процессов. К антигенозависимым относятся иммунокомплексы реакции типа Артюса и IgE обусловленные реакции, к клеточно-обусловленным — реакции гиперчувствительности замедленного типа (А. И. Воложин, 1990).
Развивающееся хроническое воспаление в периодонте при нормальном иммунном статусе следует рассматривать как защитный барьер, предотвращающий распространение продуктов распада тканей, микроорганизмов и их токсинов в общую кроволимфоциркуляцию из зоны инфекционного воспаления около верхушки корня зуба (Ю. М. Максимовский, 1996).
Вместе с тем формирование такого защитного барьера может нарушаться из-за повышения вирулентности микрофлоры или из-за возникновения недостаточности функционирования иммунной системы.
При этом масштаб реакции иммунной системы может быть различным, она может протекать на уровнях всего организма, при локальных воспалительных процессах (пульпит, периодонтит) отмечаются изменения в иммунологических показателях преимущественно материала из десневой борозды, в меньшей степени — в иммунограмме ротовой жидкости, и совсем едва заметные сдвиги — в иммунограмме периферической крови (Ю. М. Максимовский, 1996).
Наличие в организме человека хронических очагов инфекции может обусловить развитие и отягощать течение большого количества заболеваний. Известно более 70 нозологических форм различных очагово обусловленных заболеваний и состояний. Среди них наиболее часто упоминают ревматизм, нефриты, болезни суставов, сердечно-сосудистые и желудочно-кишечные заболевания, вегетоневрозы, болезни глаз, кожи и другие.
Роль инфекционного очага может играть всякий длительно текущий инфекционно-воспалительный процесс в том или ином органе. Хроническими стоматогенными очагами инфекции (ХСОИ) являются верхушечные периодонтиты, околокорневые и фолликулярные кисты зубов, многие заболевания краевого пародонта и слизистой оболочки полости рта (гингивиты, пародонтиты, язвенно-некротические стоматиты и т.п.), кариес зубов и другие. ХСОИ составляет от 50% и более от очагов хронической инфекции организма.
Среди очагов хронической стоматогенной инфекции и сенсибилизации необходимо различать первичные, располагающиеся в органах и тканях полости рта; вторичные, находящиеся во внутренних органах и тканях организма человека, а также транзиторные, локализующиеся, как правило, в лимфатических узлах.
В начальные сроки существования очага стоматогенной инфекции имеет место мобилизация защитных сил организма человека, которая достаточна для компенсации влияния этого очага за его пределами. Такое состояние компенсации может поддерживаться неопределенно длительное время. Однако самые различные экзогенные и эндогенные факторы, чаще неспецифического характера (перегревание или переохлаждение организма, переутомление, резкое изменение микроклимата или условий труда и быта человека, перенесенные заболевания и т.п.), приводят к быстрому истощению компенсаторных возможностей организма, активизации инфекционного очага и возникновению обусловленных заболеваний.
Взаимосвязь очага хронической стоматогенной инфекции и организма имеет весьма сложный характер. Лишь условно можно выделить следующие основные патогенетиче ские механизмы, каждый из которых в большей или меньшей степени имеет место в развитии очагово обусловленных заболеваний.
- Рефлекторный механизм. Ведущая роль отводится самому инфекционному агенту (микробам и их токсинам), который создает в очаге активные рецепторные поля раздражения. Последние рефлекторно через центры головного мозга вызывают нарушение функции вегетативной нервной системы и регуляции работы внутренних органов и систем организма с последующим развитием в них функциональных и дистрофических изменений.
- Пиофагия. На развитие и клиническую картину заболеваний пищеварительной системы особенно неблагоприятно может влиять постоянное проглатывание больным гноя, выделяющегося из зубодесневых карманов при пародонтите или из свища при хроническом гранулематозном или гранулирующем периодонтите и околокорневой кисте челюсти.
- Низкий уровень иммунологической реактивности организма человека, при котором возможно проникновение микробов из очагов стоматогенной инфекции в кровеносное русло, что клинически определяется как острый сепсис. С целью подтверждения диагноза и выбора лечебной тактики в таких случаях проводят бактериологическое исследование — посев крови на питательные среды для выявления возбудителя и определения его чувствительности к различным лекарственным препаратам (антибиотикам).
- Токсемия. Поступление в кровь токсинов микроорганизмов, находящихся в очаге хронической стоматогенной инфекции, обусловливает затяжной субфебрилитет,изменения в картине крови и другие клинические симптомы, характерные для хронической интоксикации организма.
- Аллергические механизмы. Микроорганизмы, находящиеся в очагах инфекции, вызывают сенсибилизацию организма человека и образование в нем специфических антител. При вторичном инфицировании организма тем же видом микробов возникают более выраженные общие и местные симптомы воспалительной реакции.
- Эндотоксикоз. Воспалительные процессы,локализующиеся в челюстно-лицевой области, сопровождаются эндогенной интоксикацией, обусловленной поступлением в кровь фракции эндотоксинов лизосомального происхождения, продуктов тканевого распада, бактериальных токсинов и других токсических продуктов, образующихся в самом организме в результате тех или иных нарушений жизненных функций.
- Аутоиммунный механизм. В крови появляются антигены тканевого происхождения (цитотоксины), которые образуются в результате повреждения тканей и распада белка. Цитотоксины, являясь аутоантигенами, также изменяют чувствительность организма человека и вызывают его сенсибилизацию и хронизацию воспалительного процесса.
Для диагностики эндогенной интоксикации традиционно используют клинические и лабораторные методы исследования, которые взаимно дополняют друг друга. Совокупность тестов для диагностирования эндотоксикоза обычно произвольна и определяется опытом врача, его клиническим мышлением и представлениями о проблеме эндотоксикоза, а также техническими возможностями лабораторий лечебно-профилактического учреждения.
Различают специфическую и неспецифическую лабораторную диагностику эндогенной интоксикации организма. Специфическая диагностика преследует выявление эндогенных токсинов в организме (качественная оценка) и силы их действия (количественная оценка). Этим целям отвечают методики, основанные на биопробах. Отметим, что методики биологического тестирования при эндогенной интоксикации еще не получили большого распространения в клинической практике и применяются в эксперименте.
В клинической практике чаще применяют функционально-морфологические тесты, косвенно характеризующие степень интоксикации (определение стадии деструкции лейкоцитов, НСТ-тест, лейкоцитозный индекс интоксикации Я. Я. Кальф-Калифа и др.).
Не утратили своего значения для диагностирования интоксикации следующие неспецифические методы: клинический и биохимический анализ крови, определение количества гемоглобина, СОЭ, мочевины, креатинина, остаточного азота, билирубина, трансаминаз и белков крови, амилазы, ЦИК и др. в основном для этих целей используют лабораторные показатели, характеризующие фрикции органов и систем естественной интоксикации – печени, почек, легких и кишечника. Нарушение экскреторной и метаболической фрикций перечисленных органов сопровож- дается увеличением концентрации многих, традиционно считающихся нетоксичными соединениями, которые в высоких концентрациях совместно могут проявлять неожиданно токсическую активность (С. В. Оболенский, М. Я. Малахова, 1991). Это относится не только к конечным, но и промежуточным продуктам обмена и таким веществам, как ренин, ц-АМФ, глюкагон, инсулин, паратгормон, серотонин, гистамин, адреналин и др.
Исследования последних позволили уточнить, что субстрат эндотоксикоза более широк и представлен веществами низкой и средней молекулярной массы (мочевина, креатинин, мочевая кислота, глюкоза, молочная и другие органические кислоты, аминокислоты, жирные кислоты, фосфолипиды и их производные, продукты свободно-радикального окисления и др.), которые распределяются в крови между белками-носителями и гликокалексом эритроцитов, а также олигопептидами регуляторными (тканевые гормоны) и нерегуляторными (бактериальные, ожоговые и кишечные токсины, поступившие в организм извне, и продукты аутолиза, образовавшиеся внутри организма).
Именно это позволило предложить интегральный индекс эндотоксикоза, который включает определение концентрации веществ низкой и средней молекулярной массы и олигопептидов в различных средах организма: плазме крови, на эритроцитах, моче и слюне (М. Я. Малахова, 1991) и индексы элиминации токсических продуктов с мочой и слюной и распределение этих продуктов между плазмой крови и эритроцитами (О. В. Шалак, 2000).
О. В. Шалак (2000) было доказано, что развитие эндотоксикоза одонтогенной этиологии у больных с сердечно-сосудистыми заболеваниями обусловливает возникновение синдрома взаимного отягощения, углубляющего тяжесть их состояния. Выраженность эндотоксикоза при множественных хронических очагах одонтогенной инфекции достигает уровня интоксикации, наблюдаемой при остром ограниченном воспалении околочелюстных тканей, а в большинстве случаев значительно превосходит его (О. В. Шалак, 2000). Это еще раз подтверждает необходимость своевременной санации органов и тканей полости рта у больных с заболеваниями внутренних органов и систем организма.
Какой-либо специфической клинической картины ХСОИ не существует. Нередко субъективные жалобы весьма неопределенны. Как правило, они жалуются на головную боль, слабость, озноб, потливость, головокружение, быструю утомляемость, плохой ночной сон, потерю аппетита. В некоторых случаях преобладают жалобы на повышенную раздражительность, состояние стойкого возбуждения и беспокойства. Клиническая картина заболевания в основном определяется тем, какой орган подвергается атаке.
Из объективных симптомов ведущими являются затяжной субфебрилитет, явления подчелюстного и подподбородочного лимфаденита, а также изменения в картине крови: лабильность лейкоцитарной формулы, уменьшение содержания гемоглобина и эритроцитов (вторичная анемия), возрастание СОЭ до 30–35 мм/ч и более. Отмечаются сдвиги в белковых фракциях (гиперглобулинемия).
Диагностика ХСОИ важна на ранних стадиях развития. Однако это весьма сложная задача, особенно при сочетании ее с тонзиллогенными и риногенными очагами инфекции. Затрудняет диагностику ХСОИ самолечение больных, которое существенно изменяет клиническую картину заболевания.
При уже развившемся очаговом заболевании весьма трудно, а порой и невозможно установить причинный фактор, так как часто диагностируют сразу несколько очагов хронической инфекции (в носоглотке, миндалинах, околозубных тканях и др.). В свою очередь, общие заболевания организма приводят к более активному течению очаговой стоматогенной инфекции. Возникает своеобразный порочный круг: общее и местное заболевания взаимно отягощают друг друга. Разорвать такой круг бывает нелегко. Однако несомненно, что лечение ХСОИ необходимо для профилактики и комплексного лечения очагово обусловленных заболеваний организма человека. Только после санации полости рта и устранения всех выявленных хронических воспалительных процессов лечение основного заболевания бывает эффективным.
В настоящее время стоматологи располагают достоверными клиническими и лабораторными тестами для выявления очагов хронической стоматогенной инфекции и установления степени их активности.
При подозрении на ХСОИ прежде всего необходимо выполнить:
- тщательный осмотр состояния зубов, околозубных тканей и слизистой оболочки полости рта;
- исследование электровозбудимости пульпы с помощью электродонтометра и выявить зубы с некротизированной пульпой;
- рентгенологическое обследование, в частности ортопантомографию, и диагностировать очаги инфекции в приапикальных тканях зуба, а также начальные формы заболеваний краевого пародонта и другую патологию (резидуальная и фолликулярная кисты челюстей и т.п.);
- пробу на гликоген (Шиллера — Писарева), которая способствует обнаружению скрытых форм воспалений краевого пародонта. Сущность пробы заключается в окраске йодом гликогена, количество которого в десне увеличивается соответственно выраженности воспаления. Методика пробы заключается в осушении исследуемого участка десны, изолировании его от слюны, обработке ватным шариком, слегка увлажненным раствором Шиллера — Писарева (кристаллического йода 1 г; калия йодида 2 г; дистиллированной воды 40 мл). Чем интенсивнее окрашивается десна в коричневый цвет, тем выраженное в ней воспаление;
- определение кожной чувствительности к постоянному току с помощью аппарата для электродонтометрии или для электрообезболивания зубов позволяет найти на коже лица участки с повышенной чувствительностью. Эти участки обычно соответствуют проекциям «причинных» зубов (электро-кожный тест по Гелену);
Иногда для диагностики ХСОИ возможно использовать «провокационные» пробы, направленные на достижение обострения основного заболевания путем локального механического (в том числе физического), химического или иного воздействия на «причинный» зуб. При этом следует помнить обусугублении течения сопутствующих хронических заболеваний внутренних органов, имеющих в своей основе аутоиммунный патогенез, так как дополнительное количество вводимого антигена может играть роль разрешающего фактора, что приводит к нежелательному резкому обострению аутоиммунного процесса (В. Н. Балин, 1987).
Отметим, что в амбулаторной практике доступной для выявления сенсибилизации организма является гистаминовая проба. Для этого в слизистую оболочку переходной складки в области предполагаемого очага одонтогенной инфекции вводят 0,3–0,5 мл гистамина в разведении 1:1000. Через 1,5–2 часа в случае наличия очага стоматогенной инфекции появляется боль в области «причинного» зуба, усиливающаяся при накусывании на него, и положительная перкуторная реакция. Также можно использовать и конъюнктивальную гистаминовую пробу, для чего в конъюнктивальный мешок закапывают 1–2 капли гистамина в разведении 1:100 000 или 1:500 000. При наличии в жевательном аппарате очагов стоматогенной инфекции через 1 минуту появляется выраженное расширение капилляров и покраснение слизистой оболочки глазного яблока и века. Указанная реакция не сопровождается какими-либо неприятными ощущениями и исчезает через 10–15 мин.
Гистаминовая проба не является специфичной для обнаружения очагов стоматогенной инфекции, однако комплексное применение указанных тестов позволяет проводить дифференциальную диагностику ХСОИ различной локализации. Например, положительная конъюнктивальная гистаминовая и отрицательная электрокожная пробы свидетельствуют о наличии не стоматогенной, а тонзимогенного, риногенного или иных патологических процессов, оказывающих влияние на сосудистую реакцию.
В последние годы в связи с широким применением электродонтометрии и ортопантомографии практическая значимость гистаминовых проб существенно снизилась.
При устранении ХСОИ следует помнить, что сначала удаляют явные, а затем — менее выраженные хронические очаги одонтогенной инфекции (Д. А. Энтин, 1938). Ликвидируют ХСОИ на фоне антимикробной, десенсибилизирующей терапии при участии врача-интерниста.
К срокам и объему ликвидируемых ХСОИ следует подходить индивидуально, в зависимости от состояния больного, характера течения заболеваний внутренних органов и систем организма. Иногда такие операции по устранению ХСОИ растягивают во времени, иногда выполняют симультанно (одновременно) с лечением сопутствующего заболевания. Важно помнить о необходимости устранения ХСОИ, так как их ликвидация сама по себе при многих заболеваниях организма человека носит лечебный характер (этиологический, десенсибилизирующий и др.).
Говоря об устранении хронических очагов одонтогенной инфекции, важно заметить, что стоматологические процедуры вызывают максимум бактериемии и считаются частым предрасполагающим фактором возникновения бактериального эндокардита. От 25 до 42% больных с этим заболеванием в анамнезе имели стоматологические вмешательства.
При различных диагностических манипуляциях, где имеет место кровоточивость, а также при хирургических, акушерско-гинекологических вмешательствах, которые всегда сопровождаются транзиторной профилактики ИЭ, особенно у больных с пороком сердца любой природы, следует всегда назначать антибиотики.
Для практической реализации этого положения В. Н. Шелковский (1999) всех наблюдаемых им пациентов разделил по степени риска развития инфекционного эндокардита на 2 группы:
- -я группа (умеренная степень риска) — пациенты с врожденными или приобретенными пороками сердца, с имплантированными кардиостимуляторами, а также если в анамнезе у них были ранения сердца с повреждением эндокарда;
- -я группа (высокая степень риска) — пациенты с искусственными клапанами сердца или имевшие в анамнезе ИЭ.
Пациентам с умеренной степенью риска (1-я группа) В. Н. Шелковский рекомендует за 2 часа до стоматологической операции (удаление зубов, кюретаж зубодесневых карманов, снятие зубных отложений) перорально принимать 2 грамма оксациллина или ампициллина.
Пациентам с высокой степенью риска (2-я группа) он назначает за 3 часа до хирургической санации принять per os 3 грамма оксациллина или ампиокса. При необходимости за 12 часов до стоматологической операции он также назначает внутримышечно 2 грамма ампиокса, а за 1 час до операции еще 2 грамма, затем следует вводить поддерживающие дозы в течение 2 суток (В. Н. Шелковский, 1999).
В данном контексте нельзя не привести данные рекомендаций Американской ассоциации сердца и американской коллегии кардиологов в части касающейся стратификации риска эндокардита и стоматологических манипуляций, нуждающихся в профилактическом сопровождении антибиотиками.
Группа высокого риска:
- искусственные клапаны сердца (включая биопротезы и аллотрансплантаты);
- ИЭ в анамнезе;
- сложные «синие» врожденные пороки сердца (тетрада Фалло, транспозиция крупных
- артерий и др.);
- хирургически созданные системные пульмонарные шунты
Группа умеренного риска:
- неоперированные врожденные пороки сердца: открытый артериальный проток, дефект межжелудочковой перегородки, первичный дефект межпредсердной перегородки, коарктация аорты, двустворчатый аортальный клапан;
- приобретенные пороки сердца;
- гипертрофическая кардиомиопатия;
- пролапс митрального клапана с митральной регургитацией и/или утолщением створок.
Группа низкого риска:
- изолированный вторичный дефект межпредсердной перегородки;
- оперированные врожденные пороки сердца: дефект межпредсердной перегородки, дефект межжелудочковой перегородки, открытый артериальный проток;
- аортокоронарное шунтирование в анамнезе;
- пролапс митрального клапана без митральной регургитации;
- функциональные или «невинные» сердечные шумы;
- болезнь Кавасаки в анамнезе без клапанной дисфункции;
- ревматическая лихорадка в анамнезе без порока сердца;
- наличие водителей ритма (внутрисосудистых или эпикардиальных) и имплантированных дефибрилляторов;
- Стандартно профилактика эндокардита рекомендована у пациентов из группы
- Возраст старше 65 лет;
- Сопутствующие состояния (сердечная, почечная, дыхательная или печеночная недостаточность);
- Сахарный диабет;
- Иммунодефицит, конституциональный или медикаментозный (кортикостероиды, иммунодепрессанты);
- Состояние полости рта: неадекватная гигиена;
- Особенности процедуры: значимое кровотечение; большая длительность;
- Мнение пациента после получения информации.
Стоматологические процедуры, при которых профилактика эндокардита рекомендуется в рекомендациях АНА/АСС 2002 г. изложены так:
- Экстракция зуба.
- Пародонтологические процедуры, включая хирургические операции, кюретаж, обработку корня, зондирование.
- Установка стоматологического имплантата; реимплантация зубов.
- Эндодонтическое лечение, выходящее запределы апекса.
- Субгингивальная установка антибактериальных нитей или полосок.
- Установка ортодонтических лент.
- Интралигаментарное введение местного анестетика.
- Профилактические манипуляции, вызывающие кровотечение.
В общем виде стоматологические вмешательства, в ротовой полости и на верхних дыхательных путях могут сопровождаться следующими вариантами антибиотикопрофилактики: Amoxicillin 2 g (50мг/кг) per os за час до процедуры или в/м, в/в за 0,5 часа; в случае аллергии на пенициллин — Сlindamycin 600 mg (20 мг/кг) per os, Сephalexin 2 g (50 мг/ кг) per os или Аzithromycin 500 mg (15 мг/кг) per os за час до процедуры.
В более детальном виде профилактические режимы антибиотикотерапии при стоматологических манипуляциях представлены в таблице 1.
Таблица 1. Профилактические режимы антибиотикотерапии
при стоматологических манипуляциях
Отметим, что с различными формами ХСОИ часто сталкиваются не только врачи-стоматологи, но и врачи терапевтических, хирургических, оториноларингологических, неврологических, гематологических, гинекологических и других отделений.
Наиболее яркими примерами терапевтического значения очагов хронической одонтогенной инфекции являются:
- Синдром нарушений сердечного ритма (вопреки установившемуся мнению об умеренной значимости хронического периодонтита в генезе и выраженности экстрасистол мы можем привести многочисленные клинические наблюдения об эффективности санации подобных очагов с ассоциированным излечением процесса аритмогенеза с нескольких тысяч внеочередных сердечных сокращений до единичных «перебоев», фиксируемых присуточном мониторировании ЭКГ).
- Миокардиодистрофия (наши практические наблюдения свидетельствуют о вероятности нарушений трофики миокарда при наличии очагов хронической одонтогенной инфекции с отчетливыми изменениями реполяризации и полным нивелированием изменений сегмента ST после санации очагов хронической инфекции).
- Сепсис (одним из ярких случаев значения ухода за зубами и стоматологическими манипуляционными аппаратами, устанавливаемыми в полость рта, могут служить ниже приведенные клинические примеры).
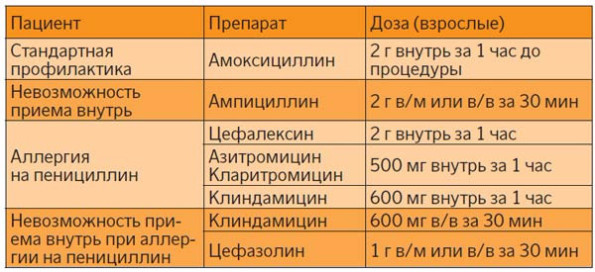
Фото 1. Данные ультразвукового исследования пациентки Н. с одонтогенными входными воротами сепсиса и формированием подпеченочного инфильтрата и абсцесса (слева) и его разрешением (справа) после 4-недельной комбинированной антибиотикотерапии.
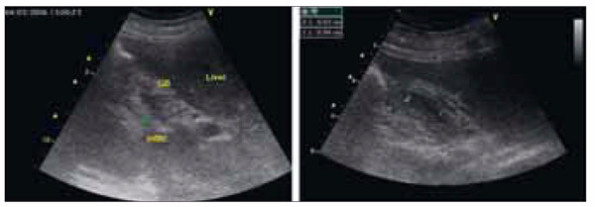
Фото 2. Данные ультразвукового исследования почки у пациентки с одонтогенным сепсисом и формированием абсцесса верхнего полюса правой почки.
Исходя из вышеизложенного, знание основных сведений по этиологии, патогенезу, клинике, принципам лечения и профилактики ХСОИ и интоксикации, а также настороженность по фактам вероятной ассоциации очагов хронической одонтогенной инфекции и заболеваний внутренних органов необходимы врачам любого профиля.
4. Инфекционный эндокардит (также проиллюстрируем клиническим примером часто встречающегося при современных методах исследования исхода воспаления пристеночного или приклапанного эндокарда).
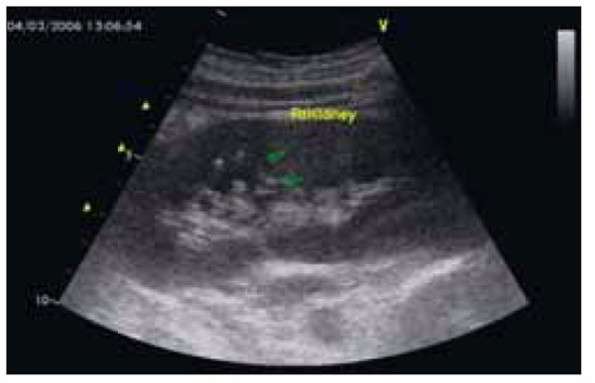
Фото 3. Данные эхокардиографии больного Р. с абортивным течением инфекционного эндокардита на створках аортального клапана и формированием аортальной недостаточности 1–2-й степени с вероятным одонтогенным происхождением генерализованного инфекционного процесса.
5. Нарушение компенсации сахарного диабета (наши клинические наблюдения свидетельствуют о значении очагов одонтогенной инфекции в неблагоприятной скачкообразной суточной динамике концентрации глюкозы крови и декомпенсации сахарного диабета; при санации ротовой полости прежний вариант гипогликемизирующей терапии может оказаться эффективным
6. Обострение хронических воспалительных заболеваний верхних отделов желудочно-кишечного тракта.
7. Обострение хронических воспалительных и невоспалительных заболеваний верхних дыхательных путей (наиболее часто терапевты встречаются со значением хронических периодонтитов, пародонтоза в поддержании или обострении хронического бронхита, инфекционно-зависимой бронхиальной астмы).
Исходя из вышеизложенного, знание основных сведений по этиологии, патогенезу, клинике, принципам лечения и профилактики ХСОИ и интоксикации, а также настороженность по фактам вероятной ассоциации очагов хронической одонтогенной инфекции и заболеваний внутренних органов необходимы врачам любого профиля.
Источник: Иорданишвили А.К., Обрезан А.Г. Хроническая стоматогенная инфекция и интоксикации организма \\ Медицина XXI век. - № 6 (7). – 2007. – С. 90-95.