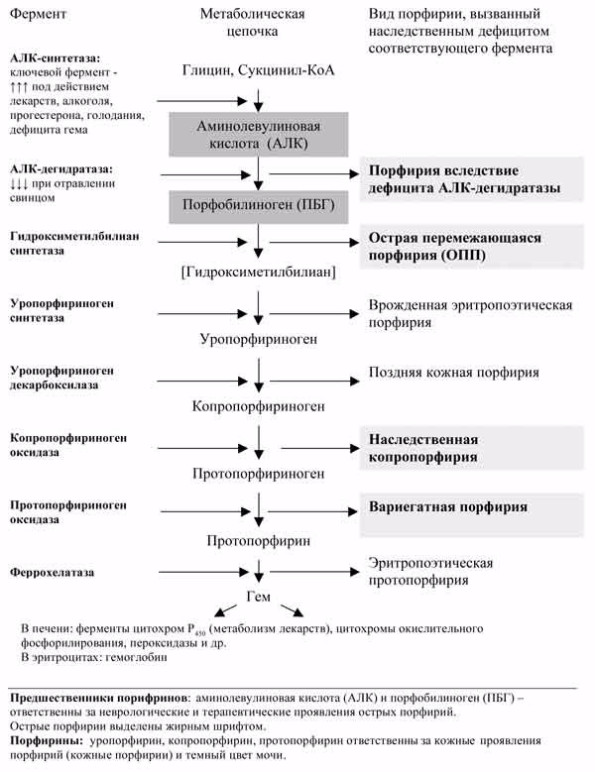
Острые порфирии – группа редких наследственных метаболических заболеваний, обусловленных частичным дефицитом одного из ферментов цепи биосинтеза гема (см. рисунок) [3, 9]. К ним относят острую перемежающуюся порфирию (ОПП), вариегатную порфирию, наследственную копропорфирию и порфирию, обусловленную дефицитом дегидратазы аминолевулиновой кислоты (АЛК). Клинически острые порфирии проявляются атаками, сопровождающимися болью в животе, легкими аффективными нарушениям, тахикардией, артериальной гипертензией, запором и другими симптомами автономной дисфункции [3]. В случае несвоевременной диагностики и неправильного лечения также может развиваться острая полиневропатия и тяжелая энцефалопатия [13]. Причиной атак является активация биосинтеза гема, которая у пациентов с острыми порфириями приводит к накоплению токсичных предшественников порфиринов – порфобилиногена (ПБГ) и АЛК в печени (см. рисунок), откуда они попадают в кровоток, а затем разносятся к тканям и органам. Основными провоцирующими факторами атак обычно являются употребление определенных лекарств, алкоголя, низкокалорийная диета, колебания гормонального фона, т. е. все то, что стимулирует синтез гема [3].
Рис. 1. Биосинтез гема и порфирии.
Как терапевтические, так и неврологические проявления острой порфирии могут имитировать другие заболевания, затрудняя выявление острой порфирии [3]. К сожалению, проблеме острых порфирий уделяется недостаточно внимания, что приводит к отсутствию настороженности врачей в отношении этой патологии. А между тем неправильная диагностика этого потенциально курабельного состояния с большой долей вероятности может привести к инвалидизации больного или его смерти [13].
Несмотря на то что существует совершенно определенное условие диагностики острых порфирий: обязательное более чем 5-кратное повышение в моче уровня предшественника порфиринов – ПБГ – во время атаки [8], нередко у пациентов с незначительным повышением уровней порфиринов и их предшественников ошибочно устанавливают диагноз острой порфирии. Даже среди случаев, описанных в периодической научной литературе, имела место гипердиагностика острых порфирий [3, 4, 6, 16, 17]. Речь идет о случаях, имеющих клиническое сходство с острой порфирией, когда незначительное повышение уровня предшественников порфиринов – АЛК и ПБГ (менее чем в 3 раза) или повышение уровня порфиринов при нормальных значениях АЛК и ПБГ, трактовали как острую порфирию. Представленные наблюдения, по-видимому, можно отнести к порфиринурии, ассоциированной с неврологической симптоматикой. Следует отметить, что они вносят путаницу в представление о неврологических проявлениях порфирии.
Ряд заболеваний и состояний сопровождается транзиторным повышением уровня порфиринов, что обозначают термином «вторичная порфиринурия» [2]. Чаще всего вторичная порфиринурия обусловлена нарушением выведения порфиринов билиарной системой на фоне различной патологии печени в отличие от повышенного синтеза порфиринов и их предшественников при порфириях. В биохимическом профиле пациентов с вторичными порфиринуриями преобладает экскреция порфиринов [2] в отличие от превалирования АЛК и ПБГ при острых порфириях [8] (см. рисунок). При вторичных порфиринуриях как терапевтическая, так и неврологическая симптоматика вызвана другой причиной, которая не должна быть упущена, а кроме того, специфическая терапия порфирии у таких пациентов бессмысленна. Таким образом, перед тем, как установить диагноз наследственной острой порфирии, необходимо провести тщательное биохимическое исследование и получить доказательные значения уровня предшественников порфиринов [8].
Мы представляем наш опыт выявления 12 пациентов со вторичными порфиринуриями, у которых изначально устанавливали диагноз острой порфирии, и приводим принципы дифференциальной диагностики этих состояний.
Пациенты и методы исследования
В материалы статьи включены данные 12 пациентов, которые были госпитализированы в неврологические отделения стационаров Санкт-Петербурга в 1998–2011 гг. и у которых первоначально был ошибочно установлен диагноз «острой порфирии». Острая порфирия была заподозрена на основании клинических симптомов, включая острую/подострую полиневропатию и энцефалопатию в сочетании с выраженным болевым синдромом и/или автономной дисфункцией. Биохимически первоначальный диагноз острой порфирии основывался на выявлении повышенных уровней порфиринов и/или их предшественников (АЛК, ПБГ) во время острой фазы заболевания, однако не превышавших 5-кратный уровень верхней границы нормы. При выявлении пациента с подозрением на острую порфирию приглашали специалиста нервно-мышечного центра для проведения дальнейшей дифференциальной диагностики.
Из 12 пациентов было 6 мужчин и 6 женщин; средний возраст составил 41 год (20–56 лет; табл. 1). Десять пациентов изначально были госпитализированы в неврологические отделения в связи с преобладающей неврологической симптоматикой, 2 пациента поступили в отделение терапевтического профиля, и неврологическая симптоматика развилась у них уже во время госпитализации. У 6 пациентов имелось указание на употребление значительного количества алкоголя незадолго до развития симптоматики, при этом у 4 – на хроническое злоупотребление алкоголем. Ни у одного из пациентов не было указаний на подобные случаи заболеваний в семье. Одна из наблюдаемых (пациентка 10; см. табл. 1) в течение длительного времени работала на производстве хрусталя, где использовали свинецсодержащий припой.
В группу сравнения вошли 16 российских и 2 финских пациента с наследственной острой порфирией, диагностированной с помощью ДНК-анализа в 1996–2011 гг. У 17 больных диагностирована ОПП, у одной пациентки – наследственная копропорфирия. Клинически острая порфирия у этой группы больных была заподозрена во время тяжелой атаки, сопровождавшейся острой полиневропатией или энцефалопатией в сочетании с выраженным болевым синдромом и/или автономной дисфункцией, и верифицирована как биохимически, так и в дальнейшем молекулярно-генетически [8, 14].
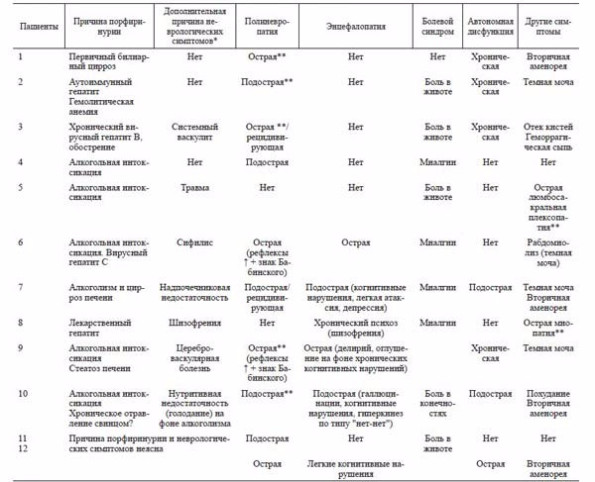
Т а б л и ц а 1. Клинические симптомы и синдромы у пациентов с вторичной порфиринурией
П р и м е ч а н и е . * – факторы, вызывающие порфиринурию, во многих случаях также могут напрямую вызывать неврологические симптомы; ** – выполнена ЭНМГ.
Методы исследования во время острой фазы заболевания. Методы исследования порфиринов и их предшественников варьировали в зависимости от лаборатории и возможностей стационара. Этим же объясняются и разные показатели нормальных значений для исследованных метаболитов. Основными методами диагностики были качественный тест Watson–Schwartz, определяющий более чем 4-кратное повышение уровня ПБГ в моче [2], а также количественная оценка АЛК и ПБГ [2, 11] и/или копропорфирина и уропорфирина в моче [15]. При этом в двух лабораториях хроматографические колонки заполняли вручную активированным углем [11], а в двух других лабораториях использовали хроматографические колонки Bio-Rad (Bio-Rad Laboratories, США) [11]. Для исследования собирали утреннюю порцию мочи в темную стеклянную банку. Анализы проводили не более чем через 3 ч после сбора мочи.
Методы исследования во время ремиссии. Исследования проводили в Центре исследования порфирии медицинского факультета Хельсинкского университета (Финляндия). Для количественной оценки уровня экскреции АЛК и ПБГ использовали Bio-Rad анионообменные хроматографические колонки (BioRad, США) [11]. Уровень уропорфирина и копропорфирина в моче, копропорфирина и протопорфирина в кале [15] оценивали при помощи высокоэффективной жидкостной хроматографии (ВЭЖХ, HPLC) [10]. Спектры флюоресценции порфиринов плазмы исследовали методом спектрофлюометрии [2]. Исследование активности гидроксиметилбилиансинтетазы эритроцитов осуществляли с помощью спектрофотометрии путем измерения конверсии ПБГ в уропорфирин [5]. ДНК-анализ генов HMBS и CPOX проводили путем прямого секвенирования экзонов, а также интронных областей [8, 14]. Биологический материал сохраняли при -20oC защищенным от света до момента транспортировки в лабораторию.
Результаты
Вторичная порфиринурия
Общая характеристика пациентов с вторичной порфиринурией
У 12 пациентов, несмотря на клиническую картину возможной атаки острой порфирии, а также 1,5–3,5-кратное повышение уровней порфиринов и/ или их предшественников в моче, острая порфирия была исключена. Основным критерием исключения явилось менее чем 5-кратное повышение уровней предшественников порфиринов (ПБГ) в моче. Кроме того, у большинства пациентов была установлена как причина порфиринурии (в основном патология печени или употребление алкоголя), так и причина неврологической симптоматики.
Клиническая картина у пациентов с вторичной порфиринурией
У 10 пациентов ведущим клиническим синдромом была симметричная полиневропатия (см. табл. 1). Из них у 7 пациентов полиневропатия развилась до развернутой клинической картины в пределах 30 дней, т. е. соответствовала критериям острой полиневропатии, а у 3 – в течение 60 дней, т. е. была подострой в отличие от пациентов с острой порфирией, у которых полиневропатия всегда имела острое течение. У большинства пациентов полиневропатия была смешанной моторно-сенсорной с преобладанием моторного компонента, как и у пациентов с острой порфирией. Чувствительные нарушения соответствовали дистальной полиневропатии с вовлечением как поверхностной, так и, реже, глубокой чувствительности, что также принципиально не отличало их от пациентов второй группы.
Среди 5 пациентов с полиневропатией, которым была проведена электронейромиография (ЭНМГ), у 3 пациентов (2, 9, 10; см. табл. 1) выявлен преимущественно аксональный тип поражения периферических нервов, а у 2 (1 и 3) – диффузная демиелинизация. Обращает на себя внимание то, что аксонопатия была выявлена у пациентов с преимущественно токсическим генезом заболевания, а демиелинизация – с аутоиммунным. При этом для острой порфирии было бы характерно преобладание аксонопатии. Рутинное исследование цереброспинальной жидкости, выполненное у 3 пациентов группы наблюдения, патологии не выявило, также как и у больных с порфирией. У пациента 5 с клинической картиной асимметричного периферического пареза в ногах ЭНМГ верифицировала поясничную плексопатию, генез которой в дальнейшем был расценен как травматический (падения на фоне алкогольного опьянения).
Признаки острой энцефалопатии отмечались у 6 пациентов и проявлялись когнитивными нарушениями, реже делирием, галлюцинациями, угнетением сознания, очаговыми симптомами, что сближает их с пациентами второй группы, однако ни у одного пациента не было эпилептических припадков в отличие от пациентов с острыми порфириями (40% атак с энцефалопатией).
Магнитно-резонансная и компьютерная томография головного мозга не выявила острых очаговых изменений ни у одного из пациентов с энцефалопатией в отличие от 3 пациентов (из 11 пациентов, у которых выполнялась магнитно-резонансная и компьютерная томография головы) с острой порфирией, с картиной PRES (posterior reversible encephalopathy syndrome) [17].
У двух пациентов (6 и 9; см. табл. 1) отмечались признаки сочетанного поражения центрального и периферического мотонейронов, что нередко наблюдалось и у пациентов с порфирией с одномоментным развитием полиневропатии и энцефалопатии. При этом у пациентов с вторичной порфиринурией пирамидная недостаточность была обусловлена другой причиной (сифилис, сосудисто-мозговая недостаточность).
Болевой синдром был выражен у 9 пациентов, но только у 4 был представлен интенсивной болью в животе – оценка по визуально-аналоговой шкале (ВАШ) более 7 баллов [7] в отличие от пациентов с острыми порфириями, у которых полиневропатия всегда сочеталась с интенсивной болью в животе. У пациентов с вторичной порфиринурией гораздо чаще, чем боль в животе, встречались миалгии, невропатические болевые ощущения в конечностях, боль в спине. При этом чаще болевой синдром развивался одномоментно с полиневропатией или накануне ее появления.
Признаки автономной дисфункции у больных с вторичной порфиринурией чаще всего включали тахикардию, артериальную гипертензию, тошноту, рвоту. Таким образом, спектр автономной дисфункции был практически идентичен таковому у пациентов с порфириями. Вместе с тем в отличие от острой порфирии у большинства пациентов с вторичными порфиринуриями автономная дисфункция имела подострый характер.
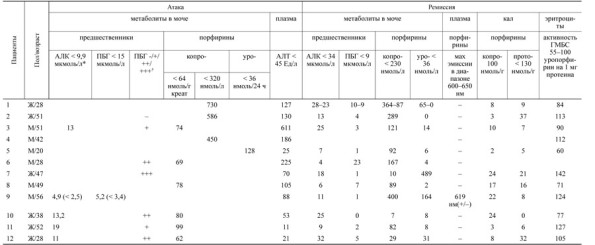
Интересными оказались электролитные и ферментные изменения у больных с вторичной порфиринурией. Так, умеренная гипонатриемия и гипокалиемия отмечалась только у одного пациента с вторичной порфиринурией и гораздо чаще обнаруживалась у пациентов с первичными порфириями. Обращало на себя внимание частое повышение уровня трансаминаз до умеренных величин (табл. 2), что, по-видимому, указывает на гепатопатию как причину вторичной порфиринурии у этих пациентов. Этот показатель, однако, не может служить критерием дифференциального диагноза, так как повышение уровня трансаминаз – частое явление у пациентов с порфириями с неврологическими симптомами (табл. 3).
Повышение уровней порфиринов и/или их предшественников у пациентов с вторичной порфиринурией
Степень повышения уровней порфиринов и/или их предшественников у пациентов группы наблюдения не превышала даже 4-кратного уровня (см. табл. 2), т. е. не соответствовала критериям диагноза атаки острой порфирии. Несмотря на это, у 8 пациентов диагноз острой порфирии был установлен в качестве безальтернативного основного диагноза, а у 2 пациентов даже была проведена специфическая патогенетическая терапия острой порфирии аргинатом гемма (Нормосанг, Orphan Drugs), при этом улучшение состояния пациентов совпало с проводимой терапией.
Для исключения острой порфирии у пациентки 7 с резко положительным качественным тестом на ПБГ (см. табл. 2) был исследован весь спектр порфиринов и их предшественников в фазе ранней ремиссии. У 7 пациентов уровни метаболитов порфиринового обмена нормализовались уже к моменту выписки из стационара. В 3 случаях нельзя было однозначно исключить острую порфирию во время острой фазы заболевания из-за постоянной копропорфиринурии (2–3-кратного повышения) и небольшого повышения уровня АЛК в одном случае. В течение 6-месячного наблюдения и повторных лабораторных исследований уровни порфиринов и их предшественников стабилизировались и у пациентов были установлены другие диагнозы.
Т а б л и ц а 2. Данные биохимических исследований у пациентов с вторичной порфиринурией
П р и м е ч а н и е . Здесь и в табл. 3: АЛК – аминолевулиновая кислота; ПБГ – порфобилиноген; АЛТ – аланинаминотрансфераза; ГМБС – гидроксиметилбилиансинтетаза; * – хроматографические колонки были вручную заполнены активированным углем; † – при проведении качественного теста Watson–Schwartz 4–5-кратное повышение уровня ПБГ соответствует +++ [2]. Незаполненные ячейки означают отсутствие соответствующих данных.
Сравнение с пациентами с острой порфирией
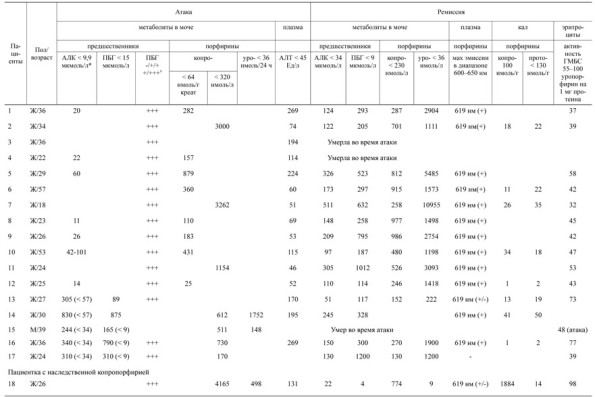
В отличие от пациентов с вторичной порфиринурией среди пациентов с острой порфирией были преимущественно женщины в возрасте 18–57 лет (средний возраст 32 года). Указание на подобные заболевания в семье у большинства пациенток также отсутствовали. Подробное описание клинической картины у 12 пациентов приведено в нашей предыдущей публикации [13].
В целом клиническая картина пациентов, страдающих острой порфирией, была сходной. Это можно отнести как к отдельным симптомам и синдромам, так и к их совокупности, однако можно отметить некоторые нюансы, клинически различающиеся у пациентов этих двух групп. В частности, у пациентов с острыми порфириями клиническая картина отличалась меньшей гетерогенностью. В отличие от пациентов с вторичной порфиринурией у всех пациентов с порфирийной полиневропатией она была острой и ей всегда предшествовали сильная боль в животе (оценка по ВАШ более 7 баллов [7]) и автономная дисфункция. У большинства пациентов острая полиневропатия развивалась вместе с энцефалопатией.
Ключевым моментом, позволяющим заподозрить острую порфирию является не столько сочетание определенных симптомов (идентичных у наших пациентов с вторичной порфинурией), но временн΄ые характеристики и последовательность их появления. В начале атаки возникает боль в животе, затем присоединяются симптомы острой автономной дисфункции, и только через 1–3 недразвивается острая полиневропатия и/или энцефалопатия.
Т а б л и ц а 3. Данные биохимических исследований у пациентов с верифицированной ОПП
Т а б л и ц а 4. Алгоритм диагностики острых порфирий
П р и м е ч а н и е . АЛК – аминолевулиновая кислота; ВП – вариегатная порфирия; ГМБС – гидроксиметилбилиан синтетаза; НК – наследственная копропорфирия; ОПП – острая перемежающаяся порфирия; ПБГ – порфобилиноген; ПКП – поздняя кожная порфирия.
Обсуждение
Следует помнить, что ряд заболеваний гепатобилиарной системы, отравления алкоголем, тяжелыми металлами, мышьяком, анемии, некоторые метаболические и инфекционные заболевания сопровождаются транзиторным повышением уровней порфиринов, в основном копропорфирина, и, реже, их предшественников [2]. Это обусловлено нарушением экскреции порфиринов с желчью, реже – частичной блокадой некоторых ферментов синтеза гемма (при отравлениях). Самой частой причиной порфиринурии считается острое или хроническое отравление алкоголем [2]. Самой тяжелой порфиринурией является отравлением свинцом, при котором уровень АЛК значительно повышен и имеет ведущее значение в патогенезе [2]. В остальных случаях порфиринурия является бессимптомным маркером, а все неврологические проявления вызваны другой причиной [2]. В литературе описаны всего 2 случая вторичных порфиринурий с неврологическими симптомами, и авторы статей предполагали, что эти симптомы обусловлены порфиринами [1, 12]. Это предположение мало вероятно, так как значительное повышение уровней порфиринов на фоне практически нормальных значений АЛК и ПБГ характерно для кожных порфирий, при которых никогда не развиваются неврологические симптомы [9].
Острую порфирию называют малым имитатором [3], и у большинства пациентов с клиническими симптомами, подозрительными в отношении острой порфирии, при обследовании выявляются другие заболевания. Это неудивительно, так как клиническая картина острой порфирии неспецифична [9]. Болевой синдром, автономная дисфункция, гипонатриемия, когнитивные нарушения и их комбинация могут также встречаться и при других полиневропатиях. Таким образом, скрининг на АЛК и ПБГ в моче должен быть выполнен у любого пациента с острой полиневропатией или энцефалопатией в сочетании с автономной дисфункцией или болевым синдромом.
Острые порфирии – редкие заболевания. Средняя распространенность ОПП в странах Западной Европы составляет 1,0–10,0 на 100 тыс. населения [9], что позволяет относить ее к редким заболеваниям, однако количество недиагностированных больных, скорее всего, превышает таковое выявленных, и, таким образом, истинная распространенность этого заболевания может быть выше.
Лабораторная диагностика имеет ключевое значение в диагностике острых порфирий [8] (табл. 4). Биохимические критерии атаки порфирии включают более чем 5-кратное повышение уровня ПБГ в моче, что может быть выявлено простыми качественными тестами Watson–Schwartz или Hoesch [2], которые очень дешевы и должны быть доступны в любом крупном стационаре. Результаты этих тестов должны всегда подтверждаться количественным измерением ПБГ в моче методом ионно-обменной хроматографии [11], так как при исследовании качественными методами возможны ложноположительные результаты (по данным литературы, до 30% [2]). В то же время необходимо иметь в виду, что разрушение ПБГ на свету (в случае, если исследуемые образцы не защищены от света) и отсроченное исследование ПБГ у больного с уже длительно текущей атакой являются основными причинами ложноотрицательных результатов.
При своевременном сборе материала, защите его от света во время сбора и транспортировки в лабораторию, а также при правильном проведении биохимических исследований установление диагноза острой порфирии во время атаки или его исключение не должно вызывать затруднений. К сожалению, некоторые лаборатории используют нестандартизованные методы количественной оценки порфиринов и их предшественников, которые менее чувствительны к повышению указанных метаболитов, что, возможно, приводит к отрицанию диагноза острой порфирии у части пациентов, обследованных в этих лабораториях. Так, обращают на себя внимание низкие показатели АЛК у наших пациентов с верифицированной в дальнейшем острой порфирией во время атаки. Эти результаты были получены при исследовании в лаборатории, использующей ручное заполнение хроматографических колонок активированным углем, что не соответствует современным лабораторным стандартам.
Анализ спектра порфиринов плазмы позволяет дифференцировать различные виды порфирий (см. табл. 4), а также подтверждает диагноз острой порфирии во время атаки [8]. Оценка биохимических показателей должна проводиться именно в момент острых симптомов, так как в дальнейшем этот уровень может снизиться, особенно при наследственной копропорфирии. У пациентов с ОПП, перенесших атаку с неврологической симптоматикой, уровень порфиринов и предшественников порфиринов обычно остается высоким пожизненно [8].
Таким образом, неврологические симптомы острых порфирий и состояний, сопровождающихся вторичной порфиринурией, могут быть идентичными. В связи с этим особое внимание должно быть уделено правильности применения алгоритма биохимической диагностики, включая не менее чем 5-кратное повышение уровня ПБГ в моче, оцененного на высоте неврологических симптомов. Основные причины ошибок интерпретации включают несвоевременный сбор биологического материала для исследования, незащищенность материала от света, проведение исследований в неспециализированных лабораториях, использование в качестве основного маркера острой порфирии только уровни копро- или уропорфиринов без исследования концентраций предшественников порфиринов – ПБГ и АЛК.
Литература
- Ahle G., Wierzba S., Haupts M. et al. Acute left hemispheric syndrome with cortical lesions in a patient with secondary porphyrinuria // J. Neurol. – 2005. – Vol. 252. – P. 983–984.
- Bonkovsky H. L., Barnard G. F. Diagnosis of porphyric syndromes: a practical approach in the era of molecular biology // Semin. Liver Dis. – 1998. – Vol. 18. – P. 57–65.
- Crimlisk H. L. The little imitator -porphyria: a neuropsychiatric disorder // J. Neurol. Neurosurg. Psychiatry. – 1997. – Vol. 62. – P. 319–328.
- Engelhardt K., Trinka E., Franz G. et al. Refractory status epilepticus due to acute hepatic porphyria in a pregnant woman: induced abortion as the sole therapeutic option? // Eur. J. Neurol. – 2004. – Vol. 11. – P. 693–697.
- Ford R. E., Ou C.-N., Ellefson R. D. Assay for erythrocyte uroporphyrinogen I synthase activity, with porphobilinogen as a substrate // Clin. Chem. – 1980. – Vol. 26. – P. 1182–1185.
- Goren M. B., Chen C. Acute intermittent porphyria with atypical neuropathy // South. Med. J. –1991. – Vol. 84. – P. 668–669.
- Jensen M. P., Karoly P. Self-report scales and procedures for assessing pain in adults // Handbook of Pain Assessment / Ed. R. Melzack. – New York: Guildford Press, 1992. – P. 135–151.
- Kauppinen R., von und zu Fraunberg M. Molecular and biochemical studies of acute intermittent porphyria in 196 patients and their families // Clin. Chem. –2002. – Vol. 48. – P. 1891–1900.
- Kauppinen R. Porphyrias // Lancet. – 2005. – Vol. 365. – P. 241– 252.
- Li F., Lim C. K., Peters T. J. Analysis of urine and faecal porphyrins by HPLC coupled to an advanced automated sample processor // Biomed. Chromatogr. – 1986. – Vol. 1. – P. 93–94.
- Mauzerall D., Granick S. Occurrence and determination of 5-aminolevulinic acid and porphobilinogen in urine // J. Biol. Chem. – 1959. – Vol. 219. – P. 435–446.
- Oberndorfer S., Hitzenberger P., Gruber W. et al. Secondary coproporphyrinuria in a patient with the full clinical picture of a hereditary acute hepatic porphyria. A misleading clinical and biochemical course // J. Neurol. – 2002. – Vol. 249. – P. 1325–1326.
- Pischik E., Bulyanitsa A., Kazakov V., Kauppinen R. Clinical features predictive of a poor prognosis in acute porphyria // J. Neurol. –2004. – Vol. 251. – P. 1538–1541.
- Pischik E., Mehtala S., Kauppinen R. Nine mutations including three novel mutations among Russian patients with acute intermittent porphyria // Hum. Mutat. – 2005. – Vol. 265. – P. 496.
- Rimington C. Quantitative determination of porphobilinogen and porphyrin in urine and faeces // Assoc. Clin. Path. Broadsheet. – 1958. – N 21. – P.
- Tan E., Kansu T., Zileli T. Severe ptosis without ophtalmoplegia due to porphyric neuropathy // Clin. Neurol. Neurosurg. – 1990. – Vol. 92. – P. 287–288.
- Yen P. S., Chen C. J., Lui C. C. et al. Diffusion-weighted magnetic resonance imaging of porphyric encephalopathy: a case report // Eur. Neurol. – 2002. – Vol. 48. – P. 119–121.
Источник: Пищик Е.Г., Казаков В.М., Руденко Д.И., Стучевская Т.Р., Посохина В.О., Обрезан А.Г., Кауппинен Р.Вторичная порфиринурия и гипердиагностика наследственных острых порфирий \\ Неврологический журнал. 2012. № 4. С. 13-21.