Диагностика АВМ
В. С. Панунцев, П. И. Никитин, В. Г. Воронов, С. Д. Раджабов, Р. Р. Байрамов
К настоящему времени имеется достаточно широкий выбор способов, позволяющих выявлять артериовенозные мальформации головного мозга. Многие из них используются на ранних стадиях проявления заболевания и позволяют существенно улучшить диагностику АВМ. Применение этих методов исследования в стационаре дает дополнительную информацию о состоянии вещества мозга, самой АВМ и церебральной гемодинамике. Результаты важны для определения показаний к тому или иному виду хирургического лечения, а также контроля проведения самой операции. Несомненно, наиболее важным методом является церебральная ангиография.
Ангиография
Разработка и внедрение ее в клиническую практику позволили прижизненно выявлять АВМ, определять ее локализацию, размер, характер кровоснабжения, а также контролировать полноту выключения из церебрального кровообращения (Хилько В. А., 1968; Рамешвили Т. Е., 1979; Корниенко В. Н., 1981; Крупина Н. Е. с соавт., 1992; Арутюнов А. И., Корниенко В. Н., 1969). С развитием эндоваскулярной нейрохирургии эта методика позволила проводить малоинвазивные оперативные вмешательства, в том числе и в неоперабельных случаях (Хилько В. А., Зубков Ю. Н., 1982).
Радиохирургическое лечение АВМ построено на принципах стереотаксического расчета зоны облучения (теми или иными лучами), в основе которых до сих пор лежит ангиографическое определение локализации облучаемого объекта в комбинации с КТ- или MPT-данными (В. Е. Pollock, 2000).
Проведение повторных ангиографий дает информацию о степени заполнения АВМ в динамике. Т. Minakawa с соавт. (1989) сообщают о динамическом ангиографическом обследовании 20 неоперированных больных: размер АВМ увеличился у 4 больных (20%), уменьшился – у 4 (20%), не изменился – у 8 (40%), мальформация не контрастировалась у 4 (20%). Р. А. Gibb с соавт. (1988) приводит ангиографически подтвержденный пример спонтанного тромбирования АВМ у девочки 8 лет. S. Wakabayashi с соавт. (1991) описывают случай роста мальформации, подтвержденный ангиографически. В работе приводится анализ 58 случаев, описанных в литературе. Показана связь длительности заболевания, возраста со степенью роста артериовенозной мальформации.
Высокая информативность церебральной ангиографии привела к закономерному ее интраоперационному применению (Martin N. A. et al., 1990; Vitaz T. W. et al., 2000; Munshi I. et al., 2000). Хотя отдельные исследователи говорят об ограничениях ее использования во время операций. По мнению Ю. М. Филатова, Е. Ф. Некипелова (1973) и S. Anegawa с соавт. (1994), интраоперационная ангиография может быть полезна для контроля удаления всех типов АВМ. Причем ни в одном случае осложнений не отмечено.
Е. Coste с соавт. (1993) и S. Anegawa с соавт. (1994) приводят позитивные результаты стереотаксической ангиографии, подчеркивая ее высокую точность и надежность. В основу этого положена максимальная автоматизация процедуры.
Несомненна ценность ангиографии для контроля радикальности вмешательств по поводу церебральных АВМ. При этом ангиография позволяет выявить дополнительные контрастные тени – мешотчатые аневризмы, другие пороки развития сосудов, не обнаруженные при первичном исследовании, но которые могут осложняться кровоизлияниями. Так, например, в работе Gao Е. с соавт. (1997) приводятся случаи образования мешотчатых аневризм после эмболизации АВМ. Takemae Т. с соавт. (1993) описывают наблюдение, в котором после вмешательства на АВМ была выявлена патологическая сосудистая сеть, характерная для болезни мойя-мойя и давшая «необъяснимое» кровоизлияние в послеоперационном периоде.
Церебральная ангиография и эндоваскулярные операции выполнялись на сериографе TRIDO-ROS-5S, включащем AOT-S, автоматический инъектор CONTRAS и электронно-оптический преобразователь SIRECON 2JJ фирмы Siemens (Германия) или на ангиографическом хирургическом комплексе «Анкор-2» (Россия–Франция). Контрастирование обеих внутренних сонных артерий и вертебробазилярного бассейна позволяло выявить участие всех сосудов в заполнении АВМ, подсчитать ее истинный объем, уточнить топографию сосудов мозга. Раздельная ангиография наружной и внутренней сонных артерий позволяла выявить приводящие сосуды из этих систем. При невозможности исследования всех бассейнов кровоснабжения мозга производили исследование сосудистого бассейна, вовлеченного в патологический процесс. Объем артериовенозных мальформаций определяли по серийным ангиограммам по методике Tonnis с учетом коэффициента рентгеновского увеличения.
Катетеры малого диаметра, разработанные в последние годы, позволили производить селективное ангиографическое исследование церебральных сосудов 2–3–4-го порядка, являющихся афферентными сосудами АВМ. Эти исследования, как правило, сочетаются с последующей эмболизацией тела АВМ различными веществами. Используются водорастворимые высокоочищенные йодсодержащие препараты, позволяющие оценить гемодинамику самой АВМ и адекватно подобрать эмболизат и параметры тромбирования мальформации. Но, несмотря на несомненную диагностическую ценность этой методики, в литературе описаны случаи, когда АВМ ангиографически не выявлялись. Так, например, C. S. Ogilvy с соавт. (1989) сообщают о 8 гистологически верифицированных АВМ, которые не были выявлены при ангиографии.
Несмотря на значительное усовершенствование рентгенологического обследования больных с заболеваниями сосудов головного мозга, ангиографическое исследование остается единственным методом, позволяющим в полной мере уточнить кровоснабжение АВМ и попутно выявить признаки внутричерепной гематомы (достаточно большого объема), вазоспазма, гидроцефалии.
Данные ангиографии позволяли не только уточнить локализацию АВМ, но и в достаточной мере определить ее объем, по крайней мере, той ее части, которая не была тромбирована или кальцифицирована и заполнялась контрастным веществом.
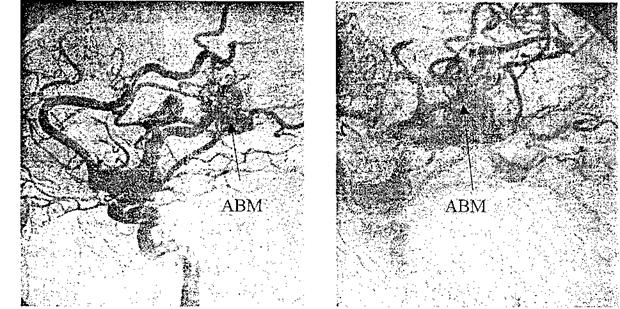
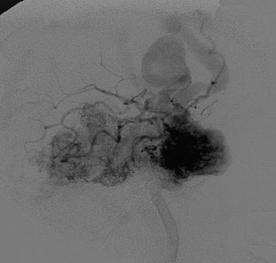
На рис. 8.1 представлены каротидные ангиограммы больного с АВМ височной доли, выполненные в режиме субтракции.
|
|
Рис. 8.1. Каротидные ангиограммы (боковая проекция) с АВМ височной доли
Мальформация располагалась в различных долях полушарий большого мозга, мозжечке, в области подкорковых ганглиев, мозолистого тела, без распространения в желудочки мозга.
Наиболее частой локализацией была теменная доля (24,3%), лобная (14,8%) или и та и другая вместе (12,7%). Зависимость локализации от типа АВМ также прослеживается более отчетливо: АВМ типа А располагались в теменной доле в 13,9%, а в лобной – в 9,2%. Расположение мальформаций типа В в теменной доле составило 7,7%, а в лобной и теменной – в 4,7%. АВМ типа С чаще занимали лобную и теменную (3,0%), теменную (2,7%), теменную и височную (2,0%). В целом, можно заключить, что в зависимости от локализации АВМ изменяется и ее тип.
У больных, которым удалось провести ангиографический анализ характера кровоснабжения при различной локализации мальформаций, из одного сосудистого бассейна (ВСА или ВББ) наиболее часто кровоснабжались АВМ теменной (32,8%), лобной (28,4%), затылочной (25,0%) и височной (23,9%) долей.
Из 2 сосудистых бассейнов (обе ВСА или ВСА и ВББ) в подавляющем большинстве случаев осуществлялось кровоснабжение АВМ, располагавшихся в лобной (47,1%), теменной (21,4%) и обеих этих долях (14,3%).
Все сосудистые бассейны головного мозга кровоснабжали мальформации, занимающие теменную долю (24,0%), лобную и теменную (19,5%) и теменную и затылочную (12,0%).
Вместе с тем для выбора хирургического лечения представляет несомненный интерес уточнение зависимости между объемом мальформации и числом «питающих» ее церебральных сосудистых бассейнов.
Количество сосудов, кровоснабжающих патологическое образование, находится в прямо пропорциональной зависимости от размеров мальформации, т. е. чем больше ее размеры, тем обширнее кровоснабжение, выявляемое при церебральной ангиографии. Преобладали больные с АВМ, кровоснабжающимися из всех сосудистых бассейнов (33,8%), обеих каротидных артерий (20,8%) и всех ветвей ВСА (18,1%). При этом АВМ типа А чаще кровоснабжались из ВСА (15,4%), и практически в равной степени из обеих ВСА (11,9%) и всех сосудистых бассейнов головного мозга (12,5%). АВМ типа В или С имели преимущественное кровоснабжение из всех сосудистых бассейнов (13,4%о и 13,6% соответственно).
Данные ангиографии, позволяющие выявить характер оттока крови, свидетельствуют о преобладании поверхностного дренирования при АВМ типа А и В (31,5% и 15,7% соответственно) и дренировании смешанного характера при АВМ типа С (8,6%).
При более подробном анализе данных ангиографического исследования было установлено, что кровоснабжение артериовенозных мальформаций головного мозга имеет свои отличительные особенности. Это, прежде всего, ускорение церебрального кровотока из-за шунтирования крови. Истинный объем мальформаций, особенно средних и больших размеров, возможно определить лишь только при быстром (8–10 мл/мин) введении адекватного количества контрастного вещества (объем последнего определяется индивидуально и, как правило, превышает 10 мл). При этом рентгеновские снимки следует выполнять, начиная с 1-й секунды, и проводить их на протяжении не менее 5 секунд.
Таким образом, приоритет ангиографического исследования в диагностике церебральных АВМ в настоящее время бесспорен. Диагностика тромбированных мальформаций с применением данного метода обследования весьма затруднительна. У нашей группы больных «выявляемость» этой сосудистой патологии при ангиографии составила 98,0%.
Ангиоархитектоника тела АВМ
Схематически артериовенозные шунтирования можно разделить на две большие категории: артериовенозные мальформации и артериовенозные фистулы. Артериовенозные мальформации представляют собой патологическую сеть между приводящими артериями и дренирующими венами. Они могут быть маленькими (микро-АВМ) с нормальным калибром артерий и вен и диаметром менее 1 см. Тогда как большие мальформации отличаются ненормальными размерами артерий и вен и диаметром тела более 3 см. Представление о компартменте АВМ возможно получить либо при ангиографии, либо после микрохирургического удаления.
Гемодинамический высокий поток и низкая перфузия ткани вследствие шунтирования мальформации могут стимулировать ангиогенез и коллатеральное кровоснабжение. Тотальное или субтотальное выключение высокопотокового шунта мальформации может препятствовать этому. Полная оценка нарушений, обусловленных наличием мальформации, заключается в изучении очагового поражения головного мозга, ангиогенетических реакций, реканализации, тромбирования сосудов, кровоизлияний. Игнорирование этих факторов может привести к неверной интерпретации как размера мальформации и ее топографии, так и определения тактики лечения.
Ангиографическими параметрами ангиоархитектоники АВМ являются: размеры, локализация, строение тела, тип кровоснабжения, характеристики венозного дренирования, локализация и число аневризм.
1. Размеры рассчитываются по математической формуле, принимающей во внимание длину 3 перпендикулярных размеров.
2. Локализацию определяли по 5 категориям: доля, глубина (глубинное, конвекситальное), правое и левое, срединная, супра- и субтенториальная.
3. Строение тела: плексиформный (сетевидный – представлен сетью патологических сосудов между приводящими артериями и дренирующими венами), фистулезный (имеется непосредственная связь между питающими артериями и венами) тип и смешанные типы.
4. Тип кровоснабжения зависит от числа и расположения сосудов, участвующих в питании АВМ, и может быть моноафферентным или полиафферентным, из 1, 2 или 3 сосудистых бассейнов.
5. Дренирующие вены распределены на 5 категорий: глубинное или поверхностное дренирование, число дренирующих вен, число больших дренирующих вен, наличие варикоза, венозное сужение (уменьшение диаметра вены на 50%).
6. Аневризмы классифицировались согласно их расположению – поверхностно питающей артерии, глубинно расположенной артерии и интранидальной (Vin˜uela F. et al., 1987; Marks M. P. et al., 1990; Turjman F. et al., 1995).
Афферентные сосуды. Сосуды, принимающие участие в кровоснабжении мальформации, могут быть разных типов:
а) прямой (концевой) – является главным афферентным стволом, питающим мальформацию;
б) транзитный – афферентные сосуды мальформации отходят от сосуда, кровоснабжающего нормальную ткань мозга.
На рис. 8.2 показано схематическое изображение представления об афферентах мальформации, а на рис. 8.3 – ангиограммы питающих мальформацию артерий.
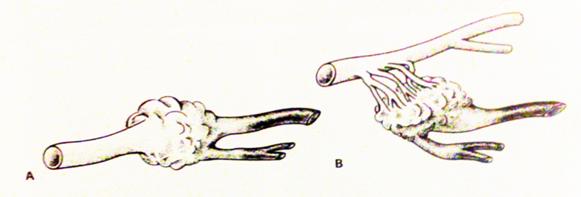
Рис. 8.2. Схема афферентных сосудов мальформаций: а – прямой; б – транзитный (Berenstein A. et al., 2004)
Прямые и транзитные афферентные сосуды могут формировать стенотические сегменты, которые в дальнейшем могут привести к увеличению коллатерального кровотока вокруг мальформации. Четкое контрастирование транзитного питания обычно прослеживается после частичной эмболизации мальформации через один из главных афферентов. Гипертрофия питающих АВМ артерий является результатом гемодинамических изменений, стимулирующих развитие сосудов, кровоснабжающих как тело мальформации, так и прилегающие зоны. В ЦНС такие гипертрофии являются причиной рацемозных субэпендимальных анастомозов. Формирование шунта зависит от гемодинамических потребностей мальформации и может повлиять на кровоснабжение нормального мозга.
|
|
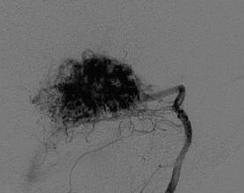
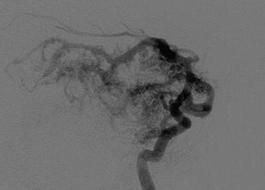
Рис. 8.3. Артерии, питающие АВМ: а – прямой тип; б – транзитный
Наличие дурального кровотока при артериовенозном шунтировании свидетельствует о характере гемодинамики и ангиогенеза мальформации.
Различают два типа дурального шунтирования:
а) прямое – к телу мальформации через дуральные лептоменингеальные анастомозы;
б) непрямое – питание мальформации осуществляется из нормальных кортикальных артерий.
Отмечено, что менингеальное шунтирование возникает после частичной эмболизации мальформации как результат ангиогенеза. Нет достоверной корреляции между дуральным шунтированием и частотой кровоизлияния.
Сообщения о частоте встречаемости мальформации с аневризмами колеблется от 2,7% (Paterson and McKissock, 1956) до 16,7% (Miyasaka Y. et al., 1982). Трудности понимания связи между мальформацией и аневризмами обусловлены недооценкой их сочетания. По данным Graf C. J. с соавт. (1983) и Perret G., Nishioka H. (1966), только у 6–7% пациентов с мальформациями встречаются аневризмы. По данным исследования Bicetre, частота встречаемости мальформаций в сочетании с аневризмами составляет от 15 до 46% и увеличивается в зависимости от размеров АВМ. Наличие аневризмы повышает риск кровоизлияния и является причиной для уточнения стратегии дальнейшего лечения. Исследования Brown R. D. с соавт. (1990) продемонстрировали увеличение риска кровоизлияния в два раза у больных с сочетанием мальформаций с аневризмой по сравнению с теми, у кого ранее кровоизлияний не было отмечено. Схематическое расположение аневризм при наличии мальформаций показано на рис. 8.4.
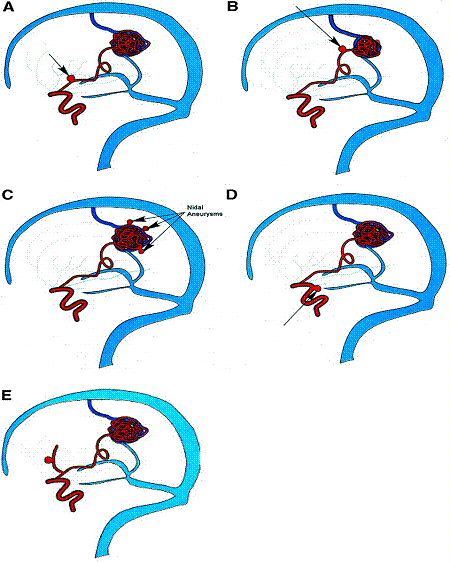
Рис. 8.4. Схема расположения сочетания аневризм при мальформациях: а, б – на питающем афферентном сосуде; в – интранидальное; г, д – на отдалении (Joint Writing Group, 2001)
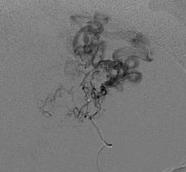
На рис. 8.5 представлены ангиограммы с вариантами локализации аневризм при больших и гигантских мальформациях.
|
|
|
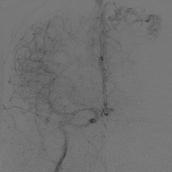
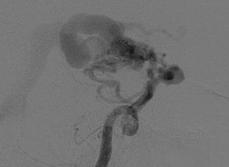
Рис. 8.5. Локализация аневризм при больших и гигантских мальформациях: а – интранидальная; б – на отдалении; в – на питающем афферентном сосуде (Joint Writing Group, 2001)
Тело мальформации. Строение тела мальформации классифицируется, прежде всего, для определения тактики хирургического вмешательства. При этом оцениваются топография, размеры, морфологические и гемодинамические показатели. Ангиографические описания компартментов мальформации также используются для классификации. При наличии нескольких приводящих артерий и венозных дренажей имеется соответствующее число компартментов АВМ (мультикомпартментные мальформации). При кровоснабжении тела мальформации из одного афферентного сосуда и наличии одиночного дренажа мальформация, как правило, имеет место одиночного компартмента. В большинстве своем большие и гигантские мальформации кровоснабжаются из нескольких бассейнов и имеют полиафферентное питание.
Классификация тела мальформации, предложенная Yasargil M. G. (1987), была представлена выше, в разделе «Анатомо-топографическая классификация АВМ».
Многие артериовенозные мальформации имеют сочетание компактного компонента (а) с диффузным (б) (рис. 8.6). Однако наличие того или иного компартмента не свидетельствует о настоящем строении тела и истинных размерах АВМ.
|
|
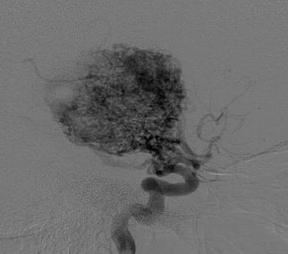
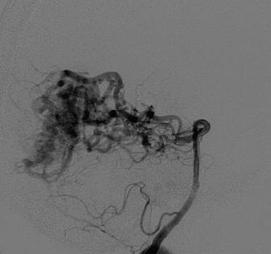
Рис. 8.6. Строение тела мальформации: а – компактное; б – диффузное
Диффузное строение тела мальформации может свидетельствовать о его продолжающемся росте в результате выраженного ангиогенеза (Yasargil M. G., 1987). С точки зрения ученых из Торонто, независимо от клинического проявления, большие размеры и глубинное расположение мальформации увеличивают риск повторных кровоизлияний.
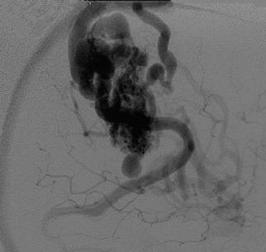
Дренирующие вены. Эктазии в пределах АВМ могут быть как артериальными, так и венозными. До 8% АВМ, проявившихся кровоизлияниями, имеют псевдоаневризмы (Garcia-Monaco et al., 1993). Их малые размеры увеличивают риск раннего кровоизлияния. Эмболизация артериовенозных мальформаций с целью снижения функционирования венозных эктазий уменьшает риск разрыва псевдоаневризм и повторных кровоизлияний. Интранидальные венозные эктазии и расширения располагаются отдельно от тела мальформации. Варианты венозных эктазий представлены на рис. 8.7, 8.8 (Berenstein A. et al., 2004). Доказать венозное происхождение псевдоаневризм сложно. Однако большинство интранидальных венозных эктазий коррелируют с нынешним представлением о кровоизлияниях. Часто глубинные мальформации сопровождаются венозными эктазиями. Изменения в течение длительного времени подчеркивают влияние гемодинамических и ангиогенетических факторов на ангиоархитектонику мальформации.
|
|

Рис. 8.7. Схема вариантов венозной эктазии: а – проксимальный венозный тромбоз; б – проксимальный венозный загиб (Berenstein A. et al., 2004)
В связи с множеством вариаций дренирования изучение венозных коллекторов является задачей сложной. Однако характеристики дренирующих вен мальформации по отношению к региональной венозной системе мозга должны быть тщательно проанализированы при подготовке стратегии эмболизации.
![]()
|
|
|
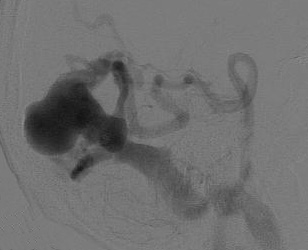
Рис. 8.8. Варианты венозных эктазий
Дренирование мальформации происходит либо в вены мозга, либо в синусы, либо в то и другое. Различные варианты дренирования показаны на рис. 8.9, 8.10.
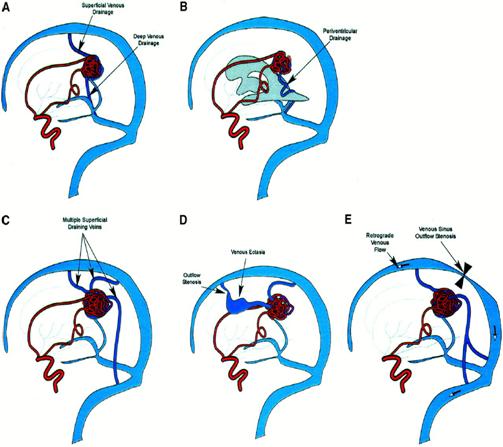 |
Рис. 8.9. Варианты венозного дренирования: (a – поверхностное и глубинное дренирование; б – перивентрикулярное дренирование; в – множественные поверхностные дренирующие вены; г – венозная эктазия и стеноз; д – ретроградное венозное дренирование и стеноз ВСС) (Joint Writing Group, 2001)
Знание локализации тела мальформации позволяет предположить дренирование в венозные коллекторы. В случаях тромбирования дренирование может измениться дополнительными коллекторами, которые бывают ипсилатеральными, контралатеральными либо через паренхиму мозга. Препятствием для дренирования могут быть тромбирование и загиб, что в некоторых случаях повышает риск повторных кровоизлияний.
Спонтанное тромбирование дренирующей вены сопровождается клиническими проявлениями, такими как головные боли, эпилептические припадки или неврологический дефицит.
|
|
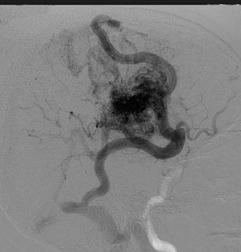
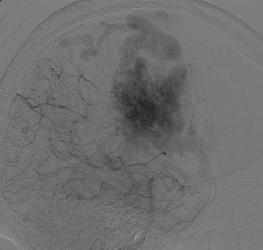
Рис. 8.10. Варианты венозного дренирования: а – глубинное дренирование; б – поверхностное дренирование
Изменения сосудов мальформации существенно влияют на риск кровоизлияния. Научно доказано, что кровотечение может быть вследствие интранидального кровоизлияния, разрыва аневризм или разрыва вен. Анализ пациентов с повторными кровоизлияниями показал, что разрыв аневризм был более частой причиной кровоизлияния (41%) по сравнению с теми, у кого аневризм не было выявлено. Наличие интранидального расположения аневризмы повышает риск кровоизлияния с 40% до 72%, тогда как расположение аневризмы на несущем афферентном сосуде повышает ежегодный риск кровоизлияния на 10%.
Также важно отметить и то, что длительность заболевания при сочетании мальформации с аневризмами увеличивает риск кровоизлияния. Наряду с этим, глубинная локализация АВМ с глубинным дренажом также повышает риск кровоизлияния. Не всегда можно встретить одновременное сочетание всех факторов риска повторных кровоизлияний. Роль ангиоархитектоники АВМ в этом несомненна.
Анализ ангиографических параметров групп нашего исследования показал достоверную зависимость клинического проявления заболевания от строения тела мальформации.
В группе клинического проявления (15 пациентов) эпилептический тип течения заболевания наблюдался у 66,7% пациентов с рацемозным строением тела АВМ. Геморрагический тип течения наблюдался у 6,7% пациентов с рацемозным строением и у 13,3% – с фистульным, а смешанный тип течения отмечен у 13,3% пациентов с рацемозным строением тела АВМ.
Зависимость клинического проявления заболевания от строения тела мальформации в группе пациентов с эпилептическим типом течения наблюдалась у 22,2% больных с рацемозным строением тела АВМ и у 11,1% – с рацемозно-фистульным. Геморрагический тип течения наблюдался у 7,4% пациентов с рацемозным строением и у 7,4% – с фистульным. Смешанный тип течения наблюдался в 40,8% наблюдений с рацемозным строением тела, в 7,4% – с фистульным. И только в 3,7% наблюдений с ишемическим типом течения отмечалось рацемозное строение тела АВМ.
АВМ с рацемозным строением тела чаще проявлялись эпилептическими припадками, при рацемозно-фистульном строении АВМ имели геморрагический и смешанный типы течения.
Анализ ангиографических показателей строения тела мальформации 16 пациентов с геморрагическим типом течения показал наличие интранидальной аневризмы у 3 (18,8%) из них. В кровоснабжении мальформации у 47,6% случаев имело место прямое питание, в 52,4% – смешанное (прямое и транзитное) питание. Наличие венозного дренирования также повлияло на манифестацию заболевания.
Компьютерная томография
Компьютерная томография проводилась на томографе фирмы General Electric (США) и отечественном томографе СРТ-1000. При необходимости использовали дополнительное контрастирование омнипаком. Этот метод способствовал диагностике морфологических изменений в головном мозге, их локализации и объема. Обращали внимание на наличие очагов ишемии, кист, гематом, гидроцефалии. Полученные данные сопоставляли с анамнестическими сведениями, клиникой заболевания и результатами ангиографического обследования, что позволило в ряде наблюдений определить характер кровоизлияния в мозг, выявить «немые» геморрагии и уточнить тип клинического течения АВМ.
Создание рентгеновского компьютерного томографа позволило практически полностью отойти от применения таких методов исследования при церебральных АВМ, как пневмоэнцефалография, вентрикулография, эхоэнцефалоскопия. Результаты применения КТ при церебральных АВМ сводятся к выявлению зон неоднородной плотности той или иной локализации, наличие которых объясняется чередованием участков свежих и давних кровоизлияний, кист, образовавшихся в результате нарушений кровообращения, крупных сосудистых лакун, содержащих кровь, а иногда и тромботические массы (Коновалов А. Н. с соавт., 1997; Axel L., 1980; Holla P. S. et al., 1982; Lee C., 1985; Kucharczuk W. еt al., 1985, и др.).
Подчеркивается ценность этой методики в диагностике свежих кровоизлияний, особенно для уточнения степени их распространения, а также в идентификации источника внутричерепной геморрагии, особенно в случаях сочетанной сосудистой патологии (АВМ и аневризмы) головного мозга (Aoki N. еt al., 1991).
Современные компьютерные томографы позволяют диагностировать АВМ, уточнить ее распространенность и, следовательно, объем. На компьютерных томограммах патогномоничным признаком является прежде всего характерное «ячеистое» строение патологического очага, имеющего участки чередования зон повышенной и пониженной плотности. В ряде случаев это исследование позволяет выявить крупные дренажные вены, попавшие в «срез» на достаточном расстоянии и имеющие вид извитых «тяжей» пониженной плотности с четкими контурами. Участки отложения солей кальция в теле АВМ выглядят как зоны небольших размеров, имеющие плотность костей черепа. Внутричерепные кисты – «бывшие» гематомы – могут располагаться как в самом теле АВМ, так и прилежать к нему. Они довольно часто носят множественный характер и свидетельствуют о неоднократных внутричерепных кровоизлияниях, протекающих нередко латентно и не вызывающих характерных клинических проявлений (рис. 8.11).
|
|
Рис. 8.11. КТ-изображение АВМ затылочной доли
При внутричерепных гематомах КТ позволяет оценить массивность кровоизлияния, наличие прорыва крови в желудочки головного мозга, локализацию и размеры самой АВМ и выбрать адекватную хирургическую тактику.
Наиболее часто выявленные мальформации располагались в теменной доле и подкорковых структурах (по 6,7% соответственно), лобной, теменной и височной (4,8%), лобной и височной, затылочной долях (по 3,8% соответственно). Из них чаще выявлялись АВМ типа В в теменной (4,8%) и лобной и височной доле (3,8%). Эти сведения коррелируют с данными ангиографического обследования наших больных.
Следует особо подчеркнуть, что АВМ типа А (38,5%) и типа В (22,1%) наиболее часто входили в число нераспознанных при КТ по причине недостаточной разрешающей способности имеющейся аппаратуры.
В случаях выявленных по КТ мальформаций важно было также определить их истинный размер, тромбированные порции и кисты, образовавшиеся из «бывших» внутричерепных гематом. Таким образом, информация об АВМ, полученная с помощью церебральной ангиографии, все же являлась приблизительной и требовала уточнений, что было крайне важно для проведения успешного хирургического вмешательства. Особенно ценно было иметь представление об истинных размерах АВМ в случаях проведения открытых операций, направленных на удаление мальформации.
Компьютерная томография позволяла выявить косвенные признаки кровоизлияний при церебральных АВМ, располагавшихся наиболее часто в лобной (27,7%) и теменной (16,6%) долях головного мозга. Несколько реже они выявлялись при локализации в лобной и височной долях, а также в глубоких отделах полушарий большого мозга (по 11,1% соответственно).
В целом косвенные признаки перенесенных геморрагий в зоне и/или самой АВМ выявлены у 46,2% больных, у которых мальформация диагностирована компьютерно-томографически (18 из 39 больных). Таким образом, КТ не выявляла АВМ в 62,5% больных, а относительно четкие данные получены только в 17,3% случаев.
Исходя из полученных данных, мы использовали следующую тактику проведения обследования. У больных с церебральными АВМ сначала проводили компьютерную томографию, что позволяло, прежде всего, заподозрить АВМ и оценить состояние окружающего мозгового вещества. В случаях внутричерепного кровоизлияния тактика обследования определялась тяжестью состояния больного. При компенсированном состоянии с верифицированным кровоизлиянием рентгеновскую компьютерную томографию проводили для выявления и уточнения локализации внутричерепной гематомы. Наиболее часто гематома располагалась в теле АВМ и/или в прилежащем веществе мозга. Объем ее был небольшой, и потому не вызывал гипертензионно-дислокационного синдрома.
При суб- и, особенно, декомпенсированном состоянии КТ-исследование было первоочередным и часто выявляло внутричерепную геморрагию без проведения люмбальной пункции. При этом, как правило, определялась внутримозговая гематома, четко контурировались желудочки мозга, выявлялась их деформация, степень которой зависела от величины гематомы.
Внутричерепная гематома не была диагностирована этой методикой в 45,5%, а выявленные гематомы наиболее часто располагались в затылочной доле или в глубоких отделах полушарий большого мозга и имели распространение в желудочки мозга (по 13,6% соответственно).
Данные, полученные при КТ-исследовании в случаях прорыва крови в желудочки мозга, целесообразно разделять на 2 варианта. При первом варианте четко выявлялись внутримозговая гематома и ее внутрижелудочковая часть. Дислокация желудочковой системы не определялась или она была значительной при большой гематоме. Имелась гидроцефалия различной степени выраженности. Наиболее типичным местом прорыва крови из гематомы лобной доли являлся передний рог бокового желудочка, а из гематомы височной доли – латеральная стенка бокового желудочка.
При втором варианте внутрижелудочковой геморрагии четко определялись внутрижелудочковая гематома и признаки расширения желудочков мозга. Изменения в плотности вещества мозга носили ишемический характер или имели признаки нарастающего отека.
Степень внутрижелудочковой геморрагии варьировала от гематомы переднего рога или тампонады одного из боковых желудочков до тотальной тампонады кровью всех желудочков мозга. Преобладали признаки гидроцефалии различной степени выраженности.
Следует отметить, что компьютерная томография не у всех больных выявляет внутричерепные гематомы. Не всегда выявляются гематомы лобной доли и субдурального пространства. В нашем исследовании выявляемость внутричерепных гематом составила 55,5%.
При внутрижелудочковых кровоизлияниях встречается ошибочная диагностика тотальной тампонады желудочковой системы из-за того, что плотность крови в желудочковой системе при гемотампонаде сгустками близка к плотности внутрижелудочкового ликвора со значительной примесью крови. С учетом того, что в этих ситуациях прогноз заболевания (при тампонаде всех желудочков сгустками крови летальность практически равна 100%) и тактика лечения различны, представляется важным определение степени вентрикулярной геморрагии и, в связи с этим, применение МРТ.
Таким образом, не оспаривая целесообразности проведения рентгеновской компьютерной томографии у больных с церебральными АВМ, следует подчеркнуть, что оно, несомненно, является лишь составляющей диагностического комплекса, включающего в том числе и церебральную ангиографию. В нашей работе выявляемость АВМ составила 37,5%, при этом дополнительная информация, касающаяся перенесенных больным кровоизлияний из мальформации с тромбированием ее частей и изменений в окружающем веществе мозга, получена почти у половины этих больных. Следует подчеркнуть, что наши данные определяются диагностическими возможностями примененных в исследовании КТ-аппаратов. Несомненно, что проведение исследований на новейших приборах изменит показатели в лучшую сторону.
Магнитно-резонансная томография (МРТ)
Магнитно-резонансная томография выполнялась, как правило, на амбулаторном этапе обследования больных с целью получения дополнительной информации о наличии церебральной АВМ, которой предшествовало проведение компьютерной томографии или транскраниальной доплерографии.
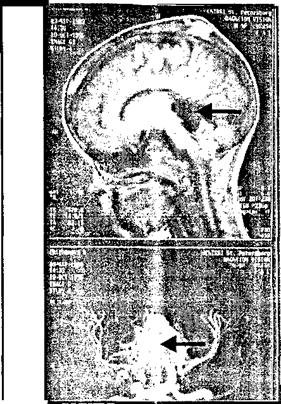
Достижения науки в последние годы позволили дополнить нейрохирургический диагностический комплекс одним из наиболее информативных методов, позволяющих судить как о патологических интракраниальных процессах в целом, так и о наличии артериовенозных мальформаций в частности. Изменения в окружающем веществе мозга, связанные с патологическим сосудистым образованием (внутричерепные гематомы, образовавшихся после разрыва АВМ, зоны ишемии, ликворные кисты и т. д.), дополняются сведениями при проведении исследования в «сосудистом» режиме, которое позволяет определять интракраниальные сосуды и саму мальформацию (рис. 8.12).
|
|
Рис. 8.12. MPT больного с АВМ
Исследование проведено 48 больным с церебральными АВМ. Тактика обследования, так же как и при КТ, определялась тяжестью состояния больных. При компенсированном состоянии, в том числе и с верифицированным кровоизлиянием из АВМ, МРТ проводили для выявления и уточнения локализации мальформации, внутричерепной гематомы (особенно при негативных данных КТ), оценки состояния окружающего мозгового вещества, в особенности при несоответствии клинических данных и информации, полученной дополнительными методами диагностики.
При суб- и, особенно, декомпенсированном состоянии МРТ проводили, в первую очередь, после внутричерепной геморрагии или с целью ее выявления. Исследование выполняли последовательно в трех режимах (Т1, Т2 и «сосудистая» программы), что позволяло получить представление о наличии АВМ, внутричерепной гематомы, состоянии мозгового вещества (зоны ишемии), особенно в бассейне тех интракраниальных сосудов, которые осуществляют «питание» АВМ.
При внежелудочковых гематомах сгустки крови в паренхиме мозга выявлены у всех больных. Как правило, выявлялась АВМ, внутричерепная гематома, четко контурировались желудочки мозга и определялась их деформация, степень которой зависела от величины гематомы. Совокупный анализ информации, полученной в режиме Т1 и Т2, давал представление о состоянии вещества головного мозга в целом.
Данные МРТ, так же как и при рентгеновской компьютерной томографии головного мозга, в случаях прорыва крови в желудочки мозга можно разделить на 2 варианта. При первом варианте четко выявлялись внутримозговая гематома, место ее проникновения в желудочковую систему и ее вентрикулярная часть. Дислокация желудочковой системы не определялась или обнаруживалась и была значительной при большой гематоме. Имелась выраженная гидроцефалия. Была отчетлива и реакция окружающего мозгового вещества – признаки отека и ишемии, распространявшиеся на оба полушария и ствол головного мозга.
При втором варианте внутрижелудочковой геморрагии четко определялись внутрижелудочковая гематома и признаки расширения желудочков мозга. Степень внутрижелудочковой геморрагии варьировала от гематомы переднего рога или тампонады одного из боковых желудочков до тотальной тампонады кровью всех желудочков мозга. Преобладали признаки выраженной гидроцефалии, резкой ишемии и отека мозгового вещества.
Не принижая роли информации о состоянии вещества головного мозга, следует особо подчеркнуть важность изображения сосудов головного мозга и артериовенозной мальформации. Полученные сведения о больных с суб- и, особенно, с декомпенсированным состоянием, проведение ангиографии которым было отсрочено или противопоказано из-за тяжести состояния, оказались особенно ценны (2 больных). При удалении внутричерепной гематомы снижался риск кровотечения из АВМ, а в случае его возникновения в распоряжении хирурга имелись данные, хотя и приблизительные, о строении сосудов и расположении самой АВМ, что снижало риск проведения хирургического вмешательства и позволяло проводить комплексное консервативное лечение в послеоперационном периоде с учетом имеющейся у больного АВМ.
При проведении компьютерной томографии, как уже было отмечено в соответствующем разделе данной главы, при внутрижелудочковых гематомах встречались случаи «гипердиагностики» тотальной тампонады желудочковой системы кровью из-за того, что плотность крови в желудочковой системе при гемотампонаде сгустками близка к плотности вентрикулярного ликвора со значительной примесью крови (72–76 ед. по Хаусфилду). Проведение МР-томографии позволяло уточнить диагноз и четко определить наличие вентрикулярной гематомы (Essig М. et al., 2000).
Таким образом, проведение МРТ больным с церебральными АВМ позволяет выявить как саму мальформацию, так и изменения в состоянии мозгового вещества, обычно связанные с нарушениями мозгового кровообращения. При компенсированном состоянии больных МРТ- исследование позволяло получить дополнительную информацию о состоянии вещества головного мозга и самой АВМ. Ценность исследования в двух режимах сканирования (по обычной и «сосудистой» программам) особенно высока при суб- и декомпенсированном состоянии больных, которым проведение ангиографического исследования невозможно из-за тяжести состояния. В послеоперационном периоде исследование в «сосудистом» режиме позволяет осуществлять динамический контроль за состоянием кровоснабжения мозга и мальформации, и при проведении хирургического лечения в несколько этапов (о чем пойдет речь в следующих главах) определять показания к ангиографическому исследованию или оперативному лечению.
Электроэнцефалография
Функциональное состояние головного мозга изучали с помощью электроэнцефалографического исследования. С помощью записи электроэнцефалограмм можно было не только установить сторону пораженного полушария и локализацию очага в его пределах, а также степень вовлечения стволовых структур в патологический процесс, но и оценить динамику функционального состояния головного мозга в процессе комплексного лечения. Использовали 16-канальный электроэнцефалограф фирмы Nicon–Kohden (Венгрия). Регистрация электроэнцефалограмм производилась с помощью угольных электродов, накладывающихся по международной системе «10–20». Для активации патологических проявлений, когда изменения в фоновой ЭЭГ были недостаточно убедительны или не позволяли судить о локализации процесса, обследование производили с применением функциональных нагрузок – фотостимуляции и гипервентиляции.
Электроэнцефалографическое исследование проводили при поступлении больных и в динамике на 6–10-е сутки после внутрисосудистых вмешательств, на 20-е – после открытых операций, на момент выписки больных из стационара и в отдаленном периоде.
Для оценки JICK и пульсационного индекса (ПИ) в магистральных сосудах головного мозга и АВМ до и после операций использовали общепринятую методику транскраниальной доплерографии (R. Aaslid et al., 1982; 1986).
При расположении АВМ в «функционально значимых» зонах головного мозга был применен интраоперационный мониторинг кровотока в сосудах мозга и АВМ. При удалении АВМ типов А и В проводили микрососудистую 20 МГц доплерографию в афферентных, эфферентных и «транзиторных» сосудах (Hassler W., 1986). При эмболизации АВМ типов В и С осуществляли билатеральный мониторинг линейной скорости кровотока в афферентных сосудах ипси- и магистральных артерий контрлатерального полушария в сочетании с прямым измерением давления крови в афферентных сосудах при постоянном контроле системного артериального давления (САД) в общей сонной или бедренной артериях с помощью системы Multi Dop X (DWL, Германия), микрокатетеров Balt (Франция) и мингографа М-34 (Siemens-Elema, Швеция).
Электроэнцефалография была проведена 304 больным. Ведущее значение в диагностике церебральных АВМ придавалось очаговым изменениям. Они имели свои особенности при каждом типе клинического течения мальформаций и выражались, как правило, в высокоамплитудной медленноволновой активности на стороне АВМ. В связи с этим патологические изменения биоэлектрической активности мозга целесообразно рассмотреть в каждой из клинических групп в зависимости от течения заболевания.
В группе больных в геморрагический период на ЭЭГ регистрировались выраженные общемозговые изменения в виде распространенных высокоамплитудных медленных волн или билатерально-синхронных вспышек медленной активности полиморфного характера, отражающих реакцию стволовых отделов мозга. Выраженность диффузных изменений зависела от локализации и массивности кровоизлияния. Более выраженные диффузные изменения имели место при АВМ глубоких отделов полушарий, а также при АВМ стволовой локализации. Чем ближе к геморрагическому периоду проводилось исследование, тем более выраженными были общие изменения, регистрируемые на электроэнцефалограмме, которые обычно наблюдались на протяжении одного-двух месяцев, а затем постепенно ослабевали. Однако у больных с повторными кровоизлияниями фон ЭЭГ, как правило, был изменен, наблюдалась общая дезорганизация ритма. Локальные изменения биопотенциалов были представлены острыми волнами, медленными колебаниями, чаще небольшой амплитуды, иногда сочетанием острых и медленных волн.
В ряде наблюдений в фоновой записи определялись очаги патологической биоэлектрической активности в виде разрядных форм активности. Было установлено, что локализация и выраженность ЭЭГ-проявлений в большей мере зависят от расположения АВМ и сроков, прошедших с момента кровоизлияния. Существенных различий в ЭЭГ-данных от объема АВМ выявить не удалось.
Исследования биоэлектрической активности головного мозга показали, что электроэнцефалограммы больных с клиническим течением по эпилептическому типу характеризуются разнообразием как общих, так и локальных изменений. В преобладающем большинстве наблюдений электрофизиологическое исследование позволяло установить не только сторону поражения, но и локализацию патологического очага в пределах полушария. У части больных (53%) очаговые изменения ЭЭГ в фоновой записи проявлялись медленными волнами, единичными и групповыми, чаще небольшой амплитуды, иногда сочетанием острых и медленных колебаний, в отдельных наблюдениях отмечалась зона сниженной или уплощенной активности. Однако у других больных (44%) изменения биопотенциалов носили ирритативный характер. При этом на основании анализа ЭЭГ можно было установить локализацию эпилептического фокуса. Клинико-электроэнцефалографические корреляции показали, что локализация очага патологической биоэлектрической активности довольно часто совпадала непосредственно с зоной расположения АВМ. Однако у ряда больных «эпилептический фокус» формировался не только в проекции АВМ, но и в прилежащих к АВМ отделах мозга или на значительном отдалении. Нередко наблюдалось формирование зеркальных эпилептических фокусов. Было установлено, что локализация и выраженность ЭЭГ-проявлений зависят от расположения и размеров артериовенозной мальформации, а также от длительности существования эпилептических припадков.
Анализ исследования биоэлектрической активности головного мозга показал, что ЭЭГ при АВМ с клиническим течением по смешанному типу и началом с внутричерепной геморрагии характеризуется разнообразными общими и локальными изменениями. В преобладающем большинстве наблюдений (88%) ЭЭГ-исследование позволяло установить сторону поражения и локализацию очага в пределах полушария. Локальные изменения биопотенциалов были представлены медленными волнами, сочетанием острых волн и медленных колебаний, а также разрядными формами активности. Клинико-электроэнцефалографические корреляции показали, что нередко локализация очага патологической биоэлектрической активности не совпадает с зоной расположения АВМ. Было установлено, что локализация и выраженность ЭЭГ-проявлений зависят от расположения и объема АВМ, а также от сроков, прошедших с момента кровоизлияния.
Исследования биоэлектрической активности головного мозга показали, что электроэнцефалограммы у больных с клиническим течением по смешанному типу и началом с эпилептических припадков характеризуются разнообразием как общих, так и локальных изменений. В преобладающем большинстве наблюдений (93%) ЭЭГ-исследование позволяло установить сторону поражения и локализовать патологический очаг в пределах полушария. В 66,1% наблюдений очаговые изменения ЭЭГ в фоновой записи проявлялись медленными волнами, нередко сочетанием острых и медленных колебаний. В 26,6% наблюдений изменения биопотенциалов носили ирритативный характер (разрядные формы активности). Клинико-электроэнцефалографические корреляции показали, что локализация очага патологической биоэлектрической активности часто совпадает с зоной расположения АВМ, а в ряде наблюдений эпилептический фокус формируется в прилежащих к АВМ отделах мозга или на значительном отдалении. Выраженность локальных и общих изменений зависела от расположения и объема АВМ, от длительности существования эпилептических припадков и сроков, прошедших с момента кровоизлияния.
Таким образом, проведенные исследования показали, что электроэнцефалография имеет весьма существенную диагностическую ценность как метод обследования больных с церебральными артериовенозными мальформациями.
Применение фармакологических проб
С целью определения функциональной значимости афферентных сосудов нами применена проба Wada, при которой непосредственно перед введением эмболизирующего вещества суперселективно через микрокатетер вводили соль барбитуровой кислоты короткого действия (50 мг тиопентала натрия). Тест считали положительным, если возникала или нарастала очаговая неврологическая симптоматика.
Проведено 24 внутрисосудистые операции, при которых применяли эту пробу перед эмболизацией АВМ. В 13 случаях при отрицательном тесте суперселективная эмболизация привела к появлению преходящей неврологической симптоматики лишь у одного больного. Положительный тест (11 наблюдений) получен при извитых афферентных сосудах, не позволивших подвести катетер максимально близко к телу АВМ. Развитие неврологических симптомов объяснялось попаданием тиопентала натрия в мелкие корковые сосуды, не участвующие в кровоснабжении мальформации. Проведение Wada-тecтa при АВМ, расположенных в «функционально значимых» зонах, позволяло выбрать оптимальную интраоперационну тактику и улучшить результаты эндоваскулярных вмешательств.
Комплексное лечение 344 больных включало медикаментозную терапию и хирургические вмешательства. Проводили внутричерепные (тотальное, субтотальное, частичное удаление АВМ, клипирование приводящих сосудов, удаление внутричерепных гематом) и внутрисосудистые вмешательства (окклюзию приводящих сосудов баллонами из латекса, эмболизацию эмболами из полистирола, суперселективную эмболизацию различными материалами) на АВМ, их сочетание и комбинацию с протонной терапией.
Внутричерепные операции на АВМ произведены у 46,2% больных, внутрисосудистые вмешательства – у 38,7%, а сочетанное и комбинированное лечение – у 15,1% больных. Частичным считали выключение из кровообращения до 50% объема АВМ, субтотальным – от 51% до 99%, тотальным – 100%.
Следующая глава:
Литература
Предыдущая глава:
Клинические проявления