Термин «кардиомиопатии» (КМП) впервые был предло жен W. Brigden в 1957 г. для обозначения первичных поражений миокарда неизвестной этиологии, вызывающих нарушение функции сердца и не являющихся следствием заболеваний коронарных артерий, клапанного аппарата, перикарда, системной или легочной гипертензии, а также некоторых редких вариантов поражения проводящей системы сердца.
J. Goodwin в 1989 году уточнил приведенное положение о кардиомиопатиях, как о самостоятельной, идиопатической, проградиентно текущей необратимой нозологии, имеющей четкое наследственное сцепление и первичный характер поражения сердечной мышцы.
Согласно классификации J. Goodwin различают 3 группы КМП:
- дилатационная КМП (ДКМП) – характеризуется значительной дилатацией камер сердца, систолодиастолической дисфункцией миокарда и отсутствием выраженной гипертрофии сердечной мышцы. Гемодинамика при ДКМП страдает вследствие нарушения систолической функции (сни жения ФВ ЛЖ);
- гипертрофическая КМП (ГКМП) – отличается значительной, чаще асимметричной, гипертрофией миокарда ЛЖ и/или ПЖ, отчетливым преобладанием диастолической дисфункции миокарда ЛЖ (ДД ЛЖ) и отсутствием дилатации полостей сердца. Гемодинамика при ГКМП страдает преимущественно ввиду резкого снижения ударного объема как вследствие падения диастолического наполнения, так и вследствие обструкции тракта оттока (при довольно высокой ФВ);
- рестриктивная КМП (РКМП) – характеризуется нарушением диастолического расслабления (и как следствие – напол нения) ЛЖ и/или ПЖ, уменьшением их объема, а также нормальной или почти нормальной систолической функцией. Гемодинамика при РКМП страдает исключительно ввиду резкого снижения диастолического наполнения ЛЖ и как следствие сердечного выброса (при нормальной ФВ).
По мере развития кардиологической теории и практики, благодаря открытию многих этиологических факторов и патогенетических путей развития КМП появились и некоторые уточнения в понимании традиционных видов кардиомиопатий. Так, собирательным образом описаны ЭхоКГ типы ГКМП [1]. В связи с детальным описанием некоторых патогенетических типов развития рестрикции миокарда ЛЖ, появилась также дополнительная рубрификация РКМП [2]. Кроме того, были детализованы по этиологии и некоторые подтипы ДКМП [3].
С другой стороны, показано, что при многих известных заболеваниях внутренних органов инфекционной, обменнометаболической, токсической и другой природы происходит закономерное специфическое поражение миокарда с нарушением его функций, которое иногда приобретает некоторые черты описанных выше КМП. Такая неопределенность критериев выделения КМП привела к тому, что в 1995 г. экспертами ВОЗ и Международного общества и федерации кардиологов рекомендовано использовать термин «кардиомиопатия» для всех случаев поражения миокарда, ассоциированных с нарушением его функции [4]. Согласно этой классификации ВОЗ выделяет 6 групп КМП (табл. 1).
Таблица 1. Классификация кардиомиопатий (ВОЗ, 1995).
| Группы | Варианты КМП | Примечания |
| 1 | Дилатационная КМП | В 80% случаев – идиопатическая |
| 2 | Гипертрофическая КМП | Идиопатическая |
| 3 | Рестриктивная | В большинстве случаев этиология известна |
| 4 | Аритмогенная дисплазия ПЖ | Этиология неизвестна |
| 5 | Специфические КМП**: • Ишемическая* • Гипертензивная* • Клапанные* • Воспалительные* • Дисметаболические (сахарный диабет, гипертиреоз, гипотиреоз, гемохроматоз, гиповитаминозы, амилоидоз, болезни «накопления») • Токсические и аллергические (алкогольная, радиационная, лекарственная) •Нейромышечные нарушения (мышечная дистрофия, миотоническая дистрофия, атаксия Фридрейха) • Генерализованные системные (болезни соединительной ткани, инфильтрации, гранулематозные заболевания) | Поражения миокарда известной этиологии |
| 6 | Неклассифицируемые КМП | Имеются черты различных видов КМП. Этиология неизвестна. |
* – термины, которые должны быть заменены на традиционные: ИБС, АГ, пороки сердца, миокардит;
** – «специфические (вторичные) поражения миокарда»
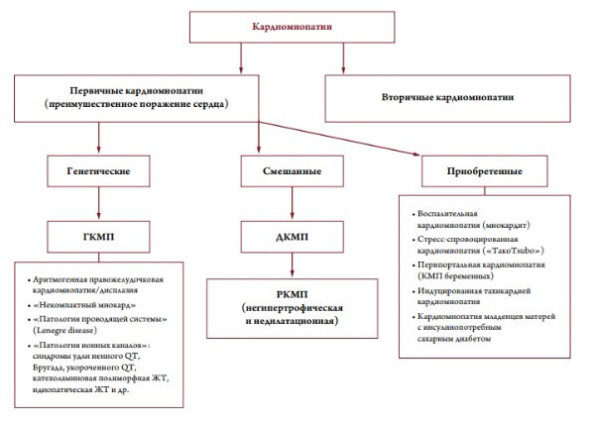
Приведенная классификация (ВОЗ, 1995) вызывала и вызывает серьезные критические замечания у большинства современных исследователей и врачей [5, 6, 7, 8]. Во-первых, термин «кардиомиопатия» предлагается использовать для обозначения неограниченного количества заболеваний сердца известной и неизвестной этиологии, для которых характерно поражение миокарда, ассоциированное с нарушением его функции. Это приводит к неоправданно широкому употреблению понятия «кардиомиопатия» и полной утрате его нозологической самостоятельности. Во-вторых, вызывает большие сомнения правомочность включения в группу «специфических КМП» так называемых «ишемической», «гипертензивной», «кла панной» кардиомиопатий, которые на самом деле представляют собой лишь последствия известных заболеваний сердечнососудистой системы (ИБС, АГ, пороков сердца), осложненных СН и/или дисфункцией желудочков. Правда, в рекомендациях экспертов ВОЗ подчеркивается, что к этим вариантам специ фических КМП должны быть отнесены только те случаи заболевания, при которых выраженность нарушений функции сердца (например, дилатация полостей) не соответствует степени нарушений коронарного кровотока, клапанных поражений, уровню АД и т.п. Однако на практике решить вопрос о таком соответствии или несоответствии в большинстве случаев не представляется возможным [5, 9]. Учитывая вышесказанное, большинство авторов склоняются к тому, чтобы использовать термин «кардиомиопатии» только в тех случаях поражения миокарда, которые не являются следствием заболеваний коронарных артерий, клапанного аппарата, перикарда, системной и легочной гипертензии, т.е. используя один из важнейших критериев J. Goodwin [7, 8, 10]. Поэтому не должны употребляться термины «ишемическая КМП», «гипертензивная КМП», «клапанная КМП». Вместо них целесообразно использовать традиционные термины: «ИБС», «пороки сердца», «АГ», «легочное сердце» и т.п. с указанием ФК ХСН. Мало того, все случаи невоспалительных поражений сердечной мышцы, этиология которых известна, должны обозначаться, как «специфические (вторичные) поражения миокарда», а болезни сердечной мышцы воспалительной природы как «миокардиты». Описанный подход деления вторичных поражений сердечной мышцы показали B.J. Maron с соавт. в своей новой классифика ции от 2006 года (рис.1) [11].
Рисунок 1. Классификация кардиомиопатий B.J.Maron, J.A.Towbin, и соавт., 2006.
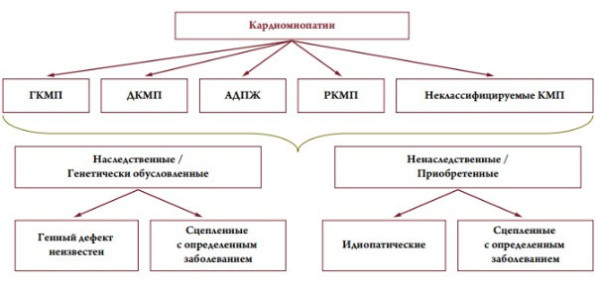
Следует отметить, что ВОЗ при введении классификации в 1995 году пользовалась инициативой научной группы P. Elliott, который в 2008 году признал ошибочными некоторые положения классификации 1995 года и предложил новое деление КМП, уже исключив ИБС, миокардиты, пороки и др. (рис. 2) [12]. Все КМП, по P. Elliott, должны представлять один из нижеследующих типов структурного ремоделирования сердца: ДКМП, РКМП или ГКМП, в том числе ненасле дуемые КМП.
Рисунок 2. Классификация кардиомиопатий (Elliott P., 2008).
Авторы статьи считают уместным по поводу основоположения в классификацию КМП преимущественно «принципа ремоделирования» следующее критическое замечание: клиническая практика показывает, что большинство ненаследуемых вторичных поражений миокарда при заболеваниях внутренних органов не сопровождаются дилатацией, констрикцией или рестрикцией вообще или длительное время. Кроме того, группа приобретенных КМП, сцепленных с определенным заболеванием, в этой классификации по-прежнему представляет собой не что иное, как конкретную нозологию, в которой утрачивается самостоятельное нозологическое звучание КМП. И, наконец, несмотря на всеобъемлющий подход, приведенная классификация не описывает всего многообразия первичных и вторичных страданий сердечной мышцы, чему посвящены нижеприведенные разделы нашей статьи.
На наш взгляд, в современных зарубежных классификациях утрачено одно важное положение – одним из ведущих факторов, определяющих структуру и функцию ЛЖ, является фактор метаболизма. Действительно, изменение обмена веществ при многих заболеваниях, не затрагивающих сердечно-сосудистую систему, приводит к трофическим нарушениям в миокарде и обусловливает изменение функционирования ЛЖ при первично интактном состоянии сердца. Не подлежит сомнению влияние нарушений обмена веществ в сердечной мышце и на диастолическое наполнение ЛЖ. Именно фактор метаболизма составляет основу для еще одной группы первичных и вторичных поражений миокарда, сведения о которых мы приводим ниже.
Миокардиодистрофия (МКД) – группа вторичных поражений сердца, основой которых являются не связанные с воспалением, опухолью или первичной дегенерацией (отложением продуктов патологического синтеза) нарушения обмена веществ и дефицит энергии в миокарде, приводящие к обратимой на ранних стадиях развития дистрофии кардиомиоцитов и клеток проводящей системы сердца, что клинически проявляется различными расстройствами сердечной деятельности.
В номенклатуру болезней миокарда термин впервые был введен Г.Ф. Лангом (1936), но не в ограниченном морфологическом содержании понятия «дистрофия» (некробиоз, мутное набухание, жировое перерождение и др.), а как более широкое клиническое и патофизиологическое понятие, раскрывающее и подчеркивающее основополагающую роль процессов дистрофии на молекулярном уровне (патобиохимических, патобиофизических) в патогенезе функциональной недостаточности сердца, возникающей при ряде заболеваний, в т. ч. (и прежде всего) в случаях, когда морфологические изменения в миокарде не обнаруживаются или по выраженности и характеру не соответствуют выявленным функциональным нарушениям [13].
Учение Г.Ф. Ланга о миокардиодистрофии, особенно в варианте, вызванном переутомлением сердечной мышцы (дистрофия от гиперфункции), намного опередило время. Дальнейшие достижения медицинской науки позволили полностью подтвердить его правильность и конкретизировать механизмы формирования энергетического дефицита в миокарде на субклеточном и молекулярном уровнях [14, 15]. Только недостаточным знакомством с этим учением можно объяснить тот факт, что болезни, относящиеся к группе МКД, в зарубежной медицинской литературе чаще обозначаются термином «миокардиопатия», который был отвергнут Г.Ф. Лангом, как «не дающий никакого представления о характере поражения миокарда». В современной отечественной кардиологии МКД рассматривается как вторичная (при различных заболеваниях), но относительно самостоятельная (по сущности патологического процесса) форма поражения миокарда, которую необходимо отличать от миокардита, опухолей сердца, болезней миокарда с неясными причинными факторами и патогенезом (так называемых КМП) и первично-дегенеративных процессов в миокарде, связанных с патологическим отложением в нем различных продуктов патологического синтеза (при амилоидозе, гемохроматозе и др.). Выявляемые при перечисленных формах патологии дистрофические изменения миокарда, сопутствующие воспалению и склерозу, не рассматривают, как самостоятельные, и к группе МКД не относят [13, 16].
В основе развития МКД всегда лежит несоответствие между расходом энергии и функционирующих структур миокарда, с одной стороны, и их восстановлением – с другой. Болезни и патологические состояния, являющиеся причинами возникновения такого несоответствия при значительном их разнообразии могут быть систематизированы в три основные группы [6, 17].
Первая группа включает болезни и патологические состояния, при которых развитие МКД связано с уменьшением поступления в организм и миокард веществ, необходимых для восстановления расходуемых структур в миокарде, либо кислорода, субстратов окисления или витаминов, которые обеспечивают процессы образования и утилизации энергии. Такова природа МКД при алиментарной дистрофии, некоторых гиповитаминозах (например, бери-бери), энтеритах с синдромом нарушенного кишечного всасывания, печеночной недостаточности (прежде всего в связи с дефицитом белков), анемии, гипобарической гипоксемии (например, при горной болезни в варианте острого высокогорного отека легких) и в других случаях гипоксии миокарда (гипоксическая миокардиодистрофия), в т. ч. при легочной недостаточности. МКД вследствие ишемии миокарда при коронарной недостаточности (являющейся причиной недостатка и перерасхода метаболических и энергетических субстратов) рассматрива ется в соответствии с учением Г.Ф. Ланга в рамках ИБС.
Вторую группу составляют болезни и патологические состояния, при которых нарушаются процессы клеточного дыхания, окислительного фосфорилирования и трансмембранного обмена катионов, в связи с чем снижаются образование энергии в миокарде и эффективность ее использования функционирующими структурами миокарда [18]. Такую природу имеют МКД при нарушениях электролитного баланса; при эндогенных (например, при уремии) и экзогенных (токсические, инфекционно-токсические МКД) интоксикациях, особенно цитотоксическими ядами, лекарствами с кардиотоксическими свойствами (например, стрептомицином, тераленом, аминазином, эметином, сердечными гликозида ми), алкоголем, микробными токсинами (при острых инфекционных болезнях, при наличии очагов хронической инфекции, например при хроническом тонзиллите), а также МКД, развивающаяся вследствие нарушения регуляции процессов обмена веществ в миокарде при стрессе, поражениях головно го мозга и периферических нервных структур (нейрогенная МКД), дисфункции эндокринных желез (эндокринопатиче ская МКД), например, при СД, тиреотоксикозе, патологиче ском климаксе, аддисонизме, гиперкортицизме [19].
Приведенная систематизация причин МКД по основным патогенетическим механизмам в определенной мере условна, так как в каждом конкретном случае возникновения МКД эти механизмы нередко сочетаются [21, 22].
Установлено, что в патогенезе разных по этиологии МКД, в том числе инфекционно-токсической, алкогольной, при уремии, гипокалиемии, гиперкатехоламинемии (стресс, патология гипоталамуса), существенное значение имеют нарушения транспорта через мембраны клеток и саркоплазматического ретикулума катионов Na+ , К+ и особенно ионов Са2+ [23, 24]. Накопление последних в саркоплазме нарушает расслабление (вплоть до контрактуры) миофибрилл и сопровождается увеличенным поглощением Са2+ митохондриями, а также активацией кальций-зависимых протеаз и фосфолипаз («кальциевая триада» по Ф.З. Меерсону), что приводит в зависимости от выраженности этих нарушений к обратимой функциональной недостаточности миокарда либо к некробиотическим повреждениям его структур. Интересно, что указанный факт известен науке длительное время, однако только в последние годы появились методы, непосредственно и в реальном времени оценивающие расслабление миокарда [25, 26].
Резервы дыхательной активности митохондрий по мере развития МКД от гиперфункции постепенно снижаются: вначале при повышенном уровне их дыхательной функции в покое, а затем и при снижении этой функции, что совпадает с клиническими проявлениями СН [13].
Классическое понимание термина «миокардиодистро фия» включает преимущественно вторичное нарушение обмена веществ в сердечной мышце. В настоящее время мож но расширить понимание миокардиодистрофий и включить в эту группу заболеваний так называемые «митохондриальные болезни».
Еще более углубленное понимание патогенеза МКД на молекулярном уровне связано с данными современных исследований, согласно которым структурная и функциональная перестройка миокарда как в процессе его гипертрофии, так и при формировании СН детерминирована соотношением экспрессии определенных генов в хромосомах клеточного ядра. Показано, например, что снижение эффективности использования энергии гипертрофированным миокардом, обусловленное уменьшением общего количества и, следовательно, общей мощности CA-насоса в саркоплазмати ческом ретикулуме, происходит на фоне снижения содержа ния мРНК, кодирующей Са2+-АТФ-азу [27].
От экспрессии генов, кодирующих каждую из нескольких изоформ Na+ , К+-АТФ-азы и миозина, зависит соотношение этих энзимов в кардиомиоцитах, которое определяет функцию миокарда и такое важное для лечебной тактики качество, как реагирование Na+-К+-АТФ-азы со строфантином. Возможные механизмы формирования эндокринопатиче ских МКД начинают раскрываться на основании полученных в последние годы данных о влиянии различных гормонов на экспрессию определенных генов. Так, трийодтиронин значительно повышает содержание в кардиомиоцитах мРНК, кодирующей синтез определенной изоформы Na+-К+-АТФазы, в то время как дексаметазон подавляет это его действие [21, 23]. Подобного рода данные создают определенные перспективы совершенствования терапии МКД путем направ ленного влияния лекарственными средствами (гормонами, индукторами ферментов и др.) на экспрессию определенных генов в зависимости от патогенеза миокардиодистрофий.
С другой стороны, более глубокое понимание основ метаболических нарушений нацеливает на применение новых инструментальных подходов в исследовании нарушений структуры и функции сердца при МКД.
Одной из важнейших составляющих нарушения обмена веществ в миокарде является нарушение гормонального баланса [28]. Прямое или опосредованное гуморальное влияние на сердце оказывают практически все биологически активные вещества, содержащиеся в плазме крови. Исследованию гормонов и их взаимоотношений при регуляции обмена веществ в миокарде и системной гемодинамики посвящены многие работы отечественных и зарубежных авторов [29, 30]. Согласно исследованиям M.S. Harris (1988) регуляторная функция многих вазоактивных пептидов и катехоламинов, таких как вазопрессин, предсердный натрийуретический фактор, адреналин, норадреналин, проявляется в отношении системного кровообращения опосредованно и зависит от структурно-функционального состояния клеточных регуляторных систем. Это позволяет предположить, что при любом изменении клеточного метаболизма в миокарде, наиболее часто наблюдающемся при дистрофических процессах, нарушаются механизмы регуляции его деятельности. Основным регуляторным механизмом гемодинамики, по данным А.В. Токаря с соавт. (1992), является плотность рецепторов к вазоактивным субстанциям, которая также зависит от трофических процессов, определяющих построение клеточных мембран. Эффекты катехоламинов, выделяемых мозговым веществом надпочечников (адреналина, норадреналина и дофамина) значительно изменяются при нарушении трофических процессов в миокарде. В последние годы активно исследуется роль новых вазоактивных субстанций, таких как эндо телин – вазоконстриктор, выделяющийся при любом повреждении сосудистой стенки или повышении чувствительности эндотелия к регуляторному пептиду [31]; инсулиноподобный фактор роста, ответственный за гиперпластические процессы в сосудистой стенке; постоянно сохраняющийся амплифайер сердечно-сосудистой системы, роль которого заключается в поддержании высокого тонуса сосудов после устранения причины, непосредственно повышающей АД [13].
Важным гормоном, имеющим непосредственное отношение к регуляции деятельности ЛЖ, является кортизол. Гемодинамические эффекты кортизола наиболее полно исследованы у больных со значительными изменениями этого гормона в крови: АГ, повышение минутного объема крови, гиперволемия, тахикардия являются гемодинамическими спутниками гиперкортизолизма [32]. Кортизол относится к первому регуляторному уровню по отношению к сердечному и ударному объему. Свойство глюкокортикоидов изменять плотность β-адренергических рецепторов в миокарде объясняет повышение АД при хроническом введении экзогенного кортизола. Кортизол может ингибировать синтез депрессорных простагландинов и таким образом повышает реактивность сосудов. По данным М.Дж. Данн (1987), при высокой концентрации кортизола метаболизм альдостерона ускоряется вследствие вытеснения его из связи с белками плазмы. Увеличение концентрации плазменного кортизола в экспериментах C.E. Wood с соавт. (1989) снижало активность ренина плазмы и не изменяло стимулированные уровни вазопрессина. Приведенные факторы способствуют увеличению нагрузки на ЛЖ и изменению условий его функционирования. Значимым регуляторным гормоном в отношении сердечно-сосудистой системы является инсулин. У пациентов с нарушением толерантности к глюкозе выявлено значительное повышение уровней АД, при этом уровень АД коррелировал с содержанием глюкозы и инсулина в крови. Даже эуглике мическая гиперинсулинемия у экспериментальных животных приводила к увеличению ангиотензин-стимулированной продукции альдостерона и усилению системных и местных эффектов АII. Инсулин регулирует пластические процессы и активность симпатического отдела нервной системы [33]. Повышение посленагрузки, гипертрофия миокарда, нарушение его иннервации, изменение структуры крупных артерий, прогрессирование кардиосклеротических процессов, изменение функционирования других гормональных систем – вот далеко не полный перечень эффектов инсулина, затрагивающих сердечно-сосудистую систему и приводящих к систолической и диастолической дисфункции у больных с миокардио дистрофиями на почве эндокринной патологии.
Термин «диабетическая миокардиодистрофия» применяется для характеристики функционального состояния миокарда у больных СД без отчетливых признаков коронарного атеросклероза [15]. В патогенезе диабетической миокарди одистрофии имеют значение три основных механизма: 1) первичное нарушение метаболизма кардиомиоцита, обусловленное нарушением всех видов обмена веществ, и в первую очередь углеводного, белкового и жирового; 2) микроангиопатия, как одно из проявлений генерализованной микроангиопатии, свойственной СД; 3) нейровегетодистрофия миокарда, обусловленная поражением вегетативной нервной системы, приводящая к нарушению регуляции сердечного ритма [34]
Для диабетической МКД характерно параллельное развитие микроангиопатии и нейровегетодистрофии в миокарде. Поражение мелких артерий и нервных волокон сердца приводит к ухудшению микроциркуляции и иннервации миокарда, что нарушает транспортную функцию, особенно кислорода, и выделение метаболитов [21]. В настоящее время предполагается, что повышение уровня эндотелина у больных диабетом и снижение вазодилатирующего фактора – оксида азота, а также сосудистая инсулинорезистентность могут играть важную роль в нарушении метаболических процессов в миокарде при инсулинзависимом СД.
Все перечисленные факторы определяют изменения структуры и функции ЛЖ, что находит отражение и в нарушении его диастолического расслабления. Наиболее ранним признаком поражения сердца при СД является снижение функции диастолического расслабления миокарда, а уже затем развивается дилатация полости ЛЖ и уменьшается амплитуда сердечных сокращений. При СД 2 типа без признаков коронарной болезни было обнаружено снижение индекса отношения пиков раннего и позднего наполнения, удлинение времени изоволюмического расслабления, что указывало на диастолическую дисфункцию ЛЖ [35]. В отечественной литературе также имеются сведения о нарушении диастолического рас слабления ЛЖ у больных СД без сердечно-сосудистой патологии. Причинами нарушения диастолической функции ЛЖ при диабетической МКД являются замедление расслабления миокарда, увеличение полости ЛЖ, повышение ригидности стенки ЛЖ, ослабление эластических свойств миокарда. В условиях энергетического дефицита при МКД значительно усугубляется и дефицит фосфокреатина, недостаточное содержание которого в миокардиальных клетках является причиной снижения локального пула АТФ в миофибриллах, вследствие чего остаются неразомкнутыми актиномиозиновые связи, возникают участки пересокращения саркомеров и контрактура миокарда, выражающаяся в повышении диастолической упругости и снижении растяжимости миокарда [36, 37].
Проведенный нами дополнительный анализ литературы позволил выделить в качестве наиболее частых и клинически значимых причин развития МКД такие состояния, как: анемия [15, 38], тиреотоксическое поражение миокарда [31], изменения сердца при физиологическом и искусственном климаксе [32], алкогольные интоксикации, СД. Нарушения миокардиальных функций у таких пациентов зачастую играют ведущую роль в клинической картине, однако механизмы их формирования и принципы ранней диагностики в настоящее время изучены недостаточно. Диагноз МКД таким пациентам не всегда своевременно устанавливается, либо данное состояние диагностируют на поздней стадии, когда манифестирует клиника СН. Недостаточно исследованы особенности изменений центральной и внутрисердечной гемодинамики, сократимости и расслабимости миокарда на сегментарном уровне при различных вариантах течения и стадиях основного заболевания, приводящих к развитию МКД [39].
В клинической практике и при проведении научных изысканий особое значение имеет проблема дифференцировки дистрофических процессов в миокарде от кардиосклеротических и ишемических. При таких состояниях, как хронические алкогольные интоксикации, тиреотоксикоз и постовариоэк томическй синдром, не представлены первично склеротические и ишемические элементы патогенеза. В свою очередь, при наличии ишемии в миокарде имеют место трофические нарушения, которые на молекулярном и уровне компартментов кардиомиоцита сходны с нарушениями на фоне тиреоток сикоза, дисовариального синдрома, алкогольных интоксикаций. В связи с чем для правильности понимания этиопатогенеза актуальнее называть миокардиодистрофии, описанные Лангом и другими авторами, как вторичные поражения миокарда. Важность выделения вторичных поражений миокарда в отдельную группу основывается на известности этиологии и патогенеза, обратимости процессов в кардиомиоцитах, которые важны как для диагностики, так и для терапии состояний, вызвавших изменения в миокарде. Отдельной группой можно вынести первичные поражения миокарда неизвестной этиологии. ИБС, системные и легочные гипертензии, пороки сердца, миокардиты стоит также рассматривать отдельно, так как эти процессы сложно объединить по этиологии, патогенезу и подходами терапии этих заболеваний.
Учитывая вышесказанное, возникающие в связи с несовер шенством приведенных классификаций терминологические проблемы рекомендуют решать следующим образом [10]:
1. КМП называют только первичные поражения миокарда, ассоциированные с нарушением функции сердца и не являющиеся следствием заболеваний коронарных артерий, клапанного аппарата, перикарда, системной и легочной гипертензии и воспалительного поражения сердечной мышцы (критерии J. Goodwin).
2. Следует выделять 4 основные группы КМП:
- ДКМП;
- ГКМП;
- РКМП;
- Аритмогенная дисплазия ПЖ.
3. Диагноз РКМП может употребляться на начальном этапе диагностического поиска и в дальнейшем требует уточнения (эндомиокардиальный фиброз, болезнь Леффлера, и др.). Исключение составляют случаи идиопатической РКМП, когда невозможно выяснить причину характерных изменений сердца.
4. Поражения миокарда известной этиологии следует обо значать, как «специфические (вторичные) поражения миокарда» и не употреблять по отношению к ним термин «кардиомиопатии», равно как другие термины (например, «миокардиодистрофии» или «миокардозы»).
5. К специфическим (вторичным) поражениям миокарда не следует относить случаи ИБС, системной и легочной гипертензии, пороки сердца и миокардиты, осложненные ХСН с нарушением систолической или/и диастолической функции миокарда.
Список литературы:
1. Romero-Farina G, Candell-Riera J Morphologic classification of hypertrophic cardiomyopathy with myocardial single photon emission tomography. Comparison with echocardiographic classification. Rev Esp Cardiol. 2000;53 (4):511–516.
2. Kushwaha SS, Fallon JT, Fuster V. Restrictive cardiomyopathy. N Engl J Med. 1997;336 (4):267–276.
3. Jefferies JL, Towbin JA. Dilated cardiomyopathy. Lancet. 2010; 375 (9716):752–762.
4. Richardson P, McKenna W, Bristow M et al. Report of the 1995 World Health Organization/International Society and Federation of Cardiology Task Force on the Definition and Classification of cardiomyopathies. Circulation. 1996;93 (5):841–842.
5. Габрусенко С.А. Гипертрофическая кардиомиопатия: современное состояние проблемы. Болезни сердца и сосудов. 2006;1:12–16.
6. Горячева А.А., Хадарцев А.А. Особенности применения милдроната у больных миокардиодистрофией. Вестник новых медицинских технологий. 2007;14 (2):201–201.
7. Миронов С.А. Сравнительная оценка методов функциональной диагностики в выявлении различных типов диастолической дисфункции. Саратовский научно-медицинский журнал. 2009;5 (2-2):207–211.
8. Кушаковский М.С. Метаболические болезни сердца (Миокардии – миокардозы – миокардиодистрофии – кардиомиопатии). – СПб.: Фолиант, 2000. – 127 с.
9. Годило-Годлевский В.А., Лубашев Я.А., Наговицын А.В. Клиникоэкспертные подходы к диагностике некоронарогенных поражений миокарда. Военно-медицинский журнал. 2007;328 (4):53–56.
10. Ройтберг Г.Е., Струтынский А.В. Внутренние болезни. Сердечнососудистая система. – М.: «Бином», 2003. – 865 с.
11. Maron BJ, Towbin JA, Thiene G et al. Contemporary definitions and classification of the cardiomyopathies: an American Heart Association Scientific Statement from the Council on Clinical Cardiology, Heart Failure and Transplantation Committee; Quality of Care and Outcomes Research and Functional Genomics and Translational Biology Interdisciplinary Working Groups; and Council on Epidemiology and Prevention. Circulation. 2006;113 (14):1807–1816.
12. Elliott P, Andersson B, Arbustini E et al. Classification of the cardiomyopathies: a position statement from the European Society Of Cardiology Working Group on Myocardial and Pericardial Diseases. Eur Heart J. 2008;29 (2):270–276.
13. Коваленко В.Н., Несукай Е.Г. Некоронарогенные болезни сердца. Практическое руководство. Под ред. В.Н. Коваленко. – К.: Морион, 2001. – 480 с.
14. Хохлов А.Л., Лейнова Е.В. Изменения сердечно-сосудистых осложнений при тиреотоксикозе у пожилых пациентов на фоне медикаментозной терапии. Проблемы стандартизации в здравоохранении. 2008; (1):169–179.
15. Гончарова Е.В., Говорин А.В., Кузьмин А.Г. и др. Структурнофункциональные показатели миокарда у больных хронической железодефицитной анемией. Кардиология. 2008;48 (5):46–50.
16. Окороков Л.Н. Диагностика болезней внутренних органов: Т. 8.
Диагностика болезней сердца и сосудов. – М.: Мед. лит., 2004. – 432 с.
17. Чепурная А.Н., Сафуанова Г.Ш., Никуличева В.И., и др. Гемическая кардиомиопатия у больных железодефицитной анемией. Кардио васкулярная терапия и профилактика. 2008;7 (22):400–401
18. Тагильцева Н.В., Изможерова Н.В., Попов А.А., и др. Частота сердечно-сосудистых заболеваний у женщин с нарушениями углеводного обмена в климактерии. Эфферентная терапия. 2007;13 (1):102.
19. Тармонова Л.Ю., Шутов A.M. Анемия и дисфункция почек у больных пожилого и старческого возраста с диастолической сердечной недоста точностью. Клиническая геронтология. 2007;13 (11):8–12
20. Dimopoulos K, Diller GP, Giannakoulas G et al. Anemia in adults with congenital heart disease relates to adverse outcome. J Am Coll Cardiol. 2009;54 (22):2093–2100.
21. Londhey VA, Kamble US, Limaye CS et al. Irreversible dilated cardiomyopathy due to thyrotoxicosis. J Assoc Physicians India. 2006;54:575–576.
22. Adams KF Jr, Piña IL, Ghali JK et al. Prospective evaluation of the association between hemoglobin concentration and quality of life in patients with heart failure. Am Heart J. 2009;158 (6):965–971.
23. Roffi M, Cattaneo F, Brandle M. Thyrotoxicosis and the cardiovascular system. Minerva Endocrinol. 2005;30 (2):47–58.
24. Flaherty G, Sharif F, Bell M et al. Reversible dilated cardiomyopathy: an unusual presentation of thyrotoxicosis. Ir Med J. 2006;99 (7):219.
25. Шиллер Н., Осипов М.А. Клиническая эхокардиография, второе издание. – М.: Практика, 2005. – 344c
26. Kosarev MM, Obrezan AG, Strel’nikov AA, Gur’ianov AV. Modern principles of diagnostics of chronic cardiac insufficiency. Klin Med (Mosk). 2011;89 (4):8–13.
27. Daly MJ, Wilson CM, Dolan SJ et al. Reversible dilated cardiomyopathy associated with post-partum thyrotoxic storm. QJM. 2009;102 (3):217–219.
28. Шляхто Е.В., Гудкова А.Я., Костарева А.А., Семернин Е.Н. Первичные кардиомиопатии, современное представление. Терапевтический архив. 2005;77 (12):77–83.
29. Марченко Е.Н., Козиолова Н.А., Смирнова Е.Н. Новый алгоритм ведения больных тиреотоксической миокардиодистрофией, осложнен ной хронической сердечной недостаточностью. Кардиоваскулярная терапия и профилактика. 2009; (2):202a–202.
30. Ngo AS, Lung Tan DC. Thyrotoxic heart disease. Resuscitation. 2006;70 (2):287–290.
31. Van de Donk NW, America YG, Zelissen PM, Hamer BJ. Takotsubo cardiomyopathy following radioiodine therapy for toxic multinodular goitre. Neth J Med. 2009;67 (10):350–352.
32. Mattar CN, Harharah L, Su LL et al. Menopause, hormone therapy and cardiovascular and cerebrovascular disease. Ann Acad Med Singapore. 2008;37 (1):54–62.
33. Миронов С.А. Сравнительная оценка методов функциональной диагностики в выявлении различных типов диастолической дисфункции. Саратовский научно-медицинский журнал. 2009;5 (2-2):207–211.
34. Волкова Ю.А. Кардио-гемодинамические показатели тиреотоксической кардиомиопатии до и после резекции щитовидной железы. Кардиоваскулярная терапия и профилактика. 2009; S:63b-64.
35. Radhakrishnan A, Granato JE. An association between Takotsubo cardiomyopathy and thyroid storm. Postgrad Med. 2009;121 (3):126–130.
36. Молчанов С.В., Коломиец Л.А., Гриднева Т. Д Менопаузальный синдром и его коррекция у онкогинекологических больных. Сибирский онкологический журнал. 2009;2:86–90.
37. Капелько В.И., Попович М.И. Метаболические и функциональные основы экспериментальных кардиомиопатий. – Кишинев: Штиинца, 1990. – 207 с.
38. Kubo T, Kitaoka H, Terauchi Y, et al. Hemolytic anemia in a patient with hypertrophic obstructive cardiomyopathy. J Cardiol. 2010;55 (1):125–129.
39. Шевченко Ю.Л., Бобров Л.Л., Обрезан А.Г. Диастолическая функция левого желудочка. Москва. – ГЭОТАР-МЕД, 2002. – 240 с.
Источник: Обрезан А.Г., Косарев М.М., Абдуалимов Т.П. Первичные и вторичные поражения сердечной мышцы: актуальные вопросы терминологии, патогенеза, гемодинамики // " Журнал Сердечная Недостаточность. Том 13, №4 (72), 2012 г." с. 241-247