Аномалии развития сердечно-сосудистой системы являются актуальной проблемой в клинической практике в связи с их возрастающей частотой и появлением новых форм и комбинаций. При этом врожденные пороки сердца становятся причиной примерно 11% младенческих смертей и до 50% всех смертей, связанных с пороками развития (А. С. Шарыкин, 2005).
Терминология и классификация врожденных пороков сердца и сосудов полностью еще не выработана. Причиной этого является то обстоятельство, что патогенез этих заболеваний не выяснен, они весьма разнообразны по виду и степени развития. Разные авторы предлагают или придерживаются различных классификаций. Встречается более 90 вариантов врожденных пороков сердца и множество их сочетаний. Случай двухкамерного сердца — уникально редкий среди них.
Двухкамерное сердце может быть отнесено к порокам бледного типа с артериовенозным шунтом, из которых обычно встречаются: дефект межжелудочковой перегородки, дефект межпредсердной перегородки, открытый артериальный проток; открытый атриовентрикулярный канал.
Основными причинами рождения детей с врожденными пороками сердца являются: хромосомные нарушения — 5%; мутация 1-го гена — 2-3%; влияние внешних факторов (алкоголизм родителей, прием лекарственных препаратов, перенесенные вирусные инфекции во время беременности и т.д.) — 12%; полигенно-мультифокальное наследование — 90%.
Врожденные пороки сердца вызывают ряд изменений компенсаторного характера, которые заставляют перестраиваться весь организм ребенка, но при длительном существовании порока процессы компенсации ведут к выраженным деструктивным изменениям органов и систем, что приводит к гибели больного.
В зависимости от состояния малого круга кровообращения в орга
низме больного с врожденным пороком сердца наблюдаются следующие патологические изменения: при наличии увеличенного кровотока в легких (пороки бледного типа с артериовенозным шунтом) развивается гиперволемия и гипертензия малого круга кровообращения.
Примерно 50% детей первого года жизни с большим сбросом крови в малый круг кровообращения без хирургической помощи погибают при явлениях сердечной недостаточности. Если ребенок переживает этот критический период, то к году в результате спазма легочных артериол уменьшается сброс крови в малый круг и состояние ребенка стабилизируется, однако это улучшение касается только самочувствия больного, так как одновременно начинают развиваться склеротические процессы в сосудах легких.
Мы представляем случай найденного двухкамерного врожденного порока сердца у взрослого человека.
Пациентка 20 лет обратилась в диагностический центр с жалобами на боли в правой подвздошной области в течение 2-х недель при изменении положения тела, при резких движениях, на одышку смешанного характера при физической нагрузке.
При опросе выяснилось, что после рождения установлен диагноз: врожденный порок сердца (ВПС) белого типа. Перинатальная энцефалопатия.
Из анамнеза болезни известно, что в 1 год 8 месяцев обследована в республиканском центре хирургии города Вильнюса. Был поставлен диагноз: единственный правый желудочек с рудиментарным левым, атрезия митрального клапана, общее предсердие, стеноз аортального клапана. Высокая легочная гипертензия А-В III ст. Зондирование сердца: давление в ЛП 18/0; ЛА 114/59; АО 84/54, общий желудочек 116/4-14 мм. рт. ст. ОЛС230% от ОПС. В оперативном вмешательстве отказано из-за высокой легочной гипертензии. Получала дигоксин. Ежегодно обследовалась в различных детских стационарах.
Неоднократно консультирована кардиохирургом в ДГБ № 1, рекомендовано консервативное лечение.
С 1999 г. получала капотен 0,0125 (3 раза), дигоксин с 1 года 8 месяцев в терапевтической дозе, с сентября 1999 года доза дигоксина снижена до кардиотрофической (0,00005 — 2 раза), с февраля 2004 г. дигоксин отменен после консультации кардиохирурга.
В августе 2006 г. обратилась к гинекологу с жалобами на боли в правой подвздошной области, усиливающиеся при резких движениях. По данным УЗИ от 07.09.06, поставлен диагноз дермоидная киста правого яичника. Дана рекомендация по удалению кисты лапароскопическим методом; рекомендована предоперационная консультация кардиолога, где и было акцентировано внимание на текущий клинический случай врожденного порока сердца.
Из анамнеза жизни известно, что пациентка родилась в Ленинграде. Первый ребенок в семье. В первом триместре беременности мама перенесла ОРВИ, ожог правой стопы. Профессиональный анамнез: с 1-го по 6-й класс обучалась на дому, с 7 класса посещала школу на общих основаниях, освобождение от уроков физкультуры. С 2005 г. обучается в университете и работает администратором.
Перенесенные заболевания: пневмония в 9 лет, коклюш в 9 лет, краснуха в 15 лет, острый гайморит в 16 лет. Не привита: отказ родителей. Гинекологический анамнез: месячные с 13,5 лет, регулярные, безболезненные. Наследственность: дедушка по папиной линии болен сахарным диабетом.
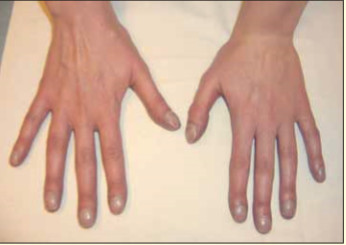
Общее состояние пациентки удовлетворительное. Сознание ясное. Телосложение правильное. Питание удовлетворительное. Вес 52 кг, рост 167 см. Кожные покровы не изменены, отмечается диффузный цианоз: ногтевые фаланги в виде «барабанных палочек», ногтевые пластинки в виде «часовых стекол», выраженный цианоз ногтевых пластинок (рис. 1).
Рис. 1. Цианоз кистей и пальцев рук, ногтевые фаланги в виде «барабанных палочек», ногтевые пластинки в виде «часовых стекол», выраженный цианоз ногтевых пластинок.
Верхушечный толчок, сердечный горб, ретростернальная или эпигастральная пульсации визуально не определяются. Пульс одинаков на обеих руках по наполнению, ритмичный, частотой 64 в минуту, удовлетворительного наполнения, не напряжен, сосудистая стенка вне волны пульса не пальпируется. Пальпация области сердца — без особенностей. Границы относительной сердечной тупости смещены вправо на 1 см; другие границы не смещены. Тоны сердца ритмичные, I тон умеренно ослаблен в 5 межреберье, акцент II тона на аорте. Грубый систолический шум над всей областью сердца. АД 105/70 мм. рт. ст.
Грудная клетка правильной формы. ЧДД 24 в минуту. При перкуссии над всей поверхностью ясный легочный звук. Дыхание везикулярное. Побочные дыхательные шумы не выслушиваются. Живот правильной формы. При поверхностной пальпации мягкий, безболезненный. При глубокой скользящей методической топографической пальпации в правом подреберье определяется нижний край печени острый, ровный, эластичный, безболезненный, выступает из-под реберной дуги на 2,0 см; поверхность печени гладкая.
Основные результаты лабораторной диагностики (табл. 1) показали компенсаторное повышение числа эритроцитов до 6,72*1012\L, уровня гемоглобина до 206 g\L, гематокрита— 62,6. Остальные показатели были в норме.
Таблица 1. Клинический анализ крови пациентки от 27.09.06.
| Параметр | Результат | Норма |
| Эритроциты / RBC (10^12/L | 6,72 | 4,3 – 5,7 |
| Гемоглобин / HGB (g/L | 206 | 132 – 173 |
| Гематокрит / HCT (%) | 62,6 | 39 – 49 |
| Средний объем эритроцита /MCV (fL) | 93,2 | 80 – 99 |
| Среднее содержание гемоглобина в эритроците / MCH (pg) | 30,7 | 27 – 34 |
| Средняя концентрация гемоглобина в эритроците / MCHC (gL) | 329 | 320 – 370 |
| Анизоцитоз эритроцитов / RDW (%) | 14,0 | 11,5 – 15,5 |
| Тромбоциты / PLT (10^9/L) | 153 | 150 - 400 |
| Средний объем тромбоцитов / MPV (fL) | 7,1 | 7,4 – 10,4 |
| Тромбокрит / PCT (%) | 0,11 | 0 – 0,999 |
| Анизоцитоз тромбоцитов / PDW (Ratio) | 17,3 | 0 – 99,9 |
| Лейкоциты / WBC ( 10^9/L) | 7,9 | 4,5 – 13 |
| Нейтрофилы / NE | 65,5 | 50 – 70 |
| Лимфоциты / LY | 16,8 | 19 – 37 |
| Моноциты / MO % | 12,8 | 3 – 11 |
По данным анализа кислотно-основного баланса венозной крови получены результаты: pH — 7,39 (норма: 7,26-7,36), pCO2 (mmHg) — 47 (норма: 46-58), pO2 ( mmHg ) — 27 (норма: 33-46). Диагностирована тенденция к гипоксии и повышение основности венозной крови (табл. 2).
Таблица 2. Результаты анализа кислотно-основного баланса венозной крови от 27.09.06.
| Венозная кровь | Результат | Норма |
| pH | 7,39 | 7,26 – 7,36 |
| pCO2 (mmHg) | 47 | 46 – 58 |
| pO2 (mmHg) | 27 | 33 – 46 |
| HCO3 (mmol/L) | 26,8 | 18 – 23 |
| BE (mmol/l ) | 0,7 | 2 – 3 |
| tCO2 (mmol/l) | 28,3 | 22 – 29 |
| tHb (g/L) | 234 | 120 – 174 |
| SO2 (%) | under 60 (measurement limit | 95 – 98 |
| Hct / c/ (%) | 70 | 34 – 51 |
| P50 (mmHg) | 26,7 | 25 – 29 |
Исследование электролитного состава крови не выявило отклонений (табл. 3).
Таблица 3. Результаты электролитного состава крови от 27.09.06.
| Эксперимент | Результат | Норма |
| Калий | 4,2 | 3,6 – 5 |
| Натрий | 141 | 137 – 145 |
| Са ионизированный | 1,21 | 1,16 – 1,32 |
Изучение параметров, характеризующих степень декомпенсации пропульсивной деятельности сердца показало лишь незначительное и прогностически благоприятное повышение уровня мозгового натрий-уретического пептида (табл. 4).
Таблица 4. Биохимическое исследование уровня мозгового натрий-уретического фактора.
| Субстрат | Результат | Норма |
| Pro-BNP (pg/ml) (венозная кровь) | 180 | 0-150 |
Уникальным представлялось соотношение показателей пульсоксиметрии (резкое снижение) и нормокардии (рис. 2).
Рис. 2. Пульсоксиметрия и частота сокращений сердца от 27.09.06.
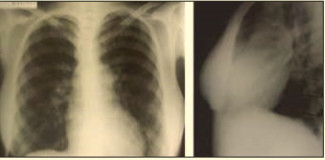
На рентгенограмме органов грудной полости наблюдалось смещение правой и левой границ сердца кнаружи (рис. 3).
Рис. 3. Рентгенограммы органов грудной полости пациентки. Умеренное увеличение желудочков сердца. Корни легких расширены.
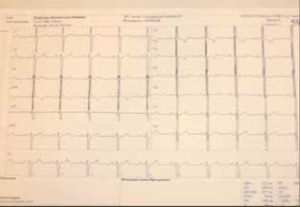
При электрокардиографии (рис. 4) выявлено отклонение электрической оси сердца влево, синдром SISIISIII — поворот верхушкой кзади; SV1-V6-тип ЭКГ в грудных отведениях—поворот вокруг верхушки по часовой стрелке; существенное смещение переходной зоны влево, умеренные нарушения реполяризации в передне-перегородочной области ЛЖ.
Рис. 4. ЭКГ пациентки.
По данным суточного мониторирования ЭКГ, ишемических изменений не выявлено, основной ритм за весь период мониторирования — синусовый с ЧСС от 49 до 132, средняя— 69, циркадный индекс 133%, снижение ЧСС ночью — в нормальных пределах. В сутки наблюдались 53 одиночные наджелудочковые экстрасистолы со средним предэктопическим интервалом в 758 мсек, 35 парных наджелудочковых экстрасистол со средним предэктопическим интервалом в 555 мсек и 2 групповые наджелудочковые экстрасистолы с ЧСС от 75 до 78 уд./мин. Таким образом, были зарегистрированы наджелудочковые аритмии, не характерные для здоровых лиц, желудочковая эктопическая активность не была зафиксирована.
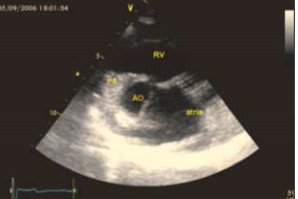
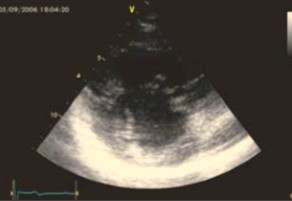
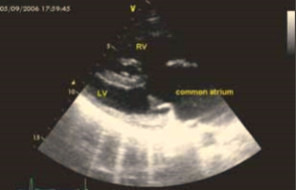
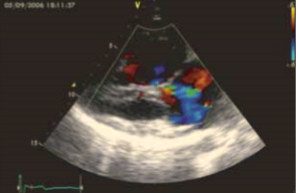
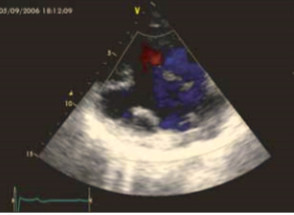
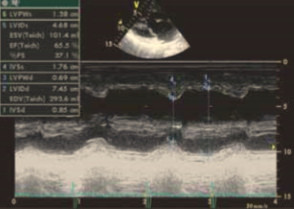
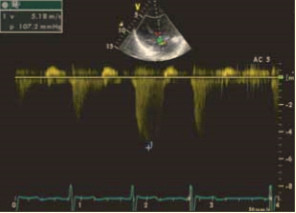
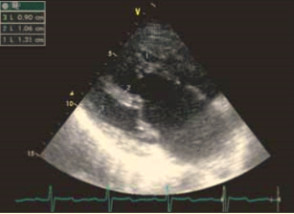
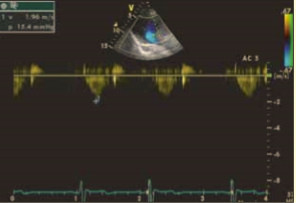
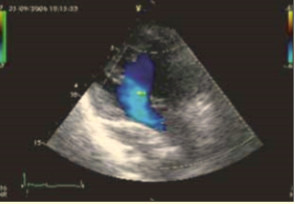
При эхокардиографии визуализировался гипертрофированный правый желудочек, сообщающийся с редуцированным левым желудочком (рис. 6, 7, 9, 12, 14), редуцированная межжелудочковая перегородка и объединенные предсердия (рис. 5, 6, 7, 8, 9), единый атрио-вентрикулярный клапан. Обращала внимание структура межжелудочковой перегородки (МЖП): перегородка представлена неким «двулистным» (рис. 7) гребнем по задней стенке сердца, составляющим от 1/3 до 1/2 размера (рис. 9, рис. 12) (в сравнении с предполагаемой нормой). Общая желудочковая фракция выброса (рис. 10) была в норме и составила 65,5%. Аортальный и пульмональный клапаны сердца были плохо доступны визуализации и предположительно не изменены.
Рис. 5. Короткая парастернальная ось: единое предсердие (atria) и доминирующий правый желудочек (RV).
Рис. 6. Верхушечная позиция: единый желудочек, единый атрио-вентрикулярный клапан и единое предсердие.
Рис. 7. Длинная парастернальная ось, видны: единое предсердие (common atrium) и сообщающиеся левый и правый желудочки (LV, RV); гребень-зачаток межжелудочковой перегородки в верхушке сердца, единый атрио-вентрикулярный клапан; крепление задней створки клапана — к гребню МЖП.
Рис. 8. Допплерография кровотока: ветрикуло-атриальная регургитация с градиентом до 105 мм рт. ст. (что соответствует систолическому АД).
Рис. 9. Верхушечная позиция: единый желудочек, единый атрио-вентрикулярный клапан и единое предсердие.
Рис. 10. Длинная парастернальная ось, морфометрия сердца: общий КДР = 7,45 см; общий КСР = 4,68 см; толщина ЗСЛЖ 0,69 см; толщина МЖП = 0,85 см.
Рис. 11. Определен высокий уровень легочной гипертензии, составляющий 107 мм рт. ст.
Рис. 12. Морфометрия сердца в В-режиме; визуализация прикрепления передней створки митрального клапана к передней стенке общего желудочка.
Рис. 13. Определен трансаортальный градиент, составляющий 15 мм рт. ст.
Рис. 14. Допплерография кровотока: выброс осуществляет доминирующий правый желудочек.
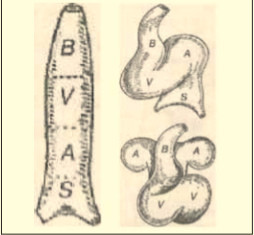
Рис. 15. Развитие сердца зародыша человека. В — артериальный ствол (конус); V — желудочки; А — предсердия; S — венозный синус. (Гайворонский И. В. Нормальная анатомия человека. Т. 1, 4-е изд., СПб, 2004).
Данные эхокардиографической находки решено трактовать как врожденный порок развития — двухкамерное сердце: единый желудочек (сообщающиеся доминантный правый и редуцированный левый), единое предсердие, единый атрио-вентрикулярный клапан, разобщенные аортальный клапан и клапан легочной артерии.
Обсуждение
Таким образом, нами продемонстрирован случай уникального клинического течения неописываемого ранее врожденного порока развития — двухкамерного сердца. Отмечена развернутая клиническая картина проявлений порока: хроническая сердечная недостаточность II A стадии, дыхательная недостаточность III ст. Осложнением необычайно длительного существования порока является высокая легочная гипертензия А-В III ст. Методом выбора для диагностики оказалась эхокардиография.
В связи с вышеизложенным возникают закономерные вопросы о генезе данного порока. Обратившись к биологическим и патофизиологическим данным, можно понять, каким образом развиваются структурно-функциональные расстройства при описываемой патологии.
Из литературных источников известно, что сердце млекопитающих начинает функционировать, еще не достигнув окончательных этапов развития. Например, сердце эмбриона мыши начинает перекачивать кровь приблизительно на 9,5 день развития. Еще через сутки можно наблюдать четкое разделение сердца эмбриона на две камеры: предсердие сверху и желудочек снизу. Разница во времени между сокращениями этих двух отделов обеспечивает эффективную работу предсердия по проталкиванию крови через сердце. Механизм управления этим процессом до сих пор был совершенно не понятен, т.к. атриовентрикулярный узел, выполняющий эту функцию у взрослых млекопитающих, у мышей развивается только на тринадцатый день внутриутробного развития.
Учеными были обнаружены ранее неизвестные клетки, выстилающие внутреннюю поверхность камер формирующегося сердца и обеспечивающие неодновременность сокращений предсердия и желудочка эмбрионального сердца. Примерно на 13,5 день двухкамерное сердце превращается в четырехкамерное с полноценно функционирующим атриовентрикулярным узлом. К этому времени обнаруженные учеными клетки отмирают, что исключает дублирование выполняемой ими функции и сбои в работе сердца.
У человека в эмбриогенезе кровеносная система сходна с характерной для рыб: двухкамерное сердце, хвостовая артерия, кровеносные сосуды в составе шести дуг аорты, подходящие к жаберным дужкам. Сюда присоединяются: общая форма тела зародыша, хвост, жаберные борозды, нитевидное продолжение заднего отдела спинного мозга. У некоторых взрослых людей можно обнаружить в скелете запястья свободную центральную косточку, характерный признак строения земноводных предков.
В ходе истории сердце как орган впервые появляется у моллюсков и членистоногих в виде пульсирующего органа, из которого кровь поступает в пространства между другими органами. Замкнутая сосудистая система с однокамерным сердцем появляется впервые у кольчатых червей. У позвоночных происходит дальнейшее совершенствование сердца и кровеносной системы. Рыбы имеют двухкамерное сердце с предсердием и желудочком, от которого отходит особая артерия, проводящая кровь к жабрам, в которых кровь обогащается кислородом. У амфибий, в связи с образованием легких, предсердие разделяется на два, и сердце становится трехкамерным. От правого предсердия отходит легочная артерия, проводящая кровь к легким. От них артериальная кровь по легочной вене идет в правое предсердие. Желудочек отдает смешанную кровь всему телу. А у рептилий, птиц и млекопитающих сердце четырехкамерное. Филогенетически развитие сердца идет от простейшего однокамерного до весьма сложного четырехкамерного, в зависимости от общей сложности организма. Ясно, что земляному червю не нужно сложное сердце, в то время как человек с сердцем червя вряд ли выживет. Однако необходимо отметить одну особенность: человеческий зародыш проходит в своем развитии различные стадии филогенеза и не обладает сразу нормальным сердцем. Его сердце проходит в онтогенезе процесс формирования всех эволюционных видов сердец.
В норме у человека сердце развивается из парного зачатка, возникающего на второй неделе жизни эмбриона. Закладка происходит на шее впереди кишки в виде двух мезодермальных трубочек. Медиальная стенка трубочек утолщена. Это зачаток сердечной мышцы и наружной оболочки сердца. Затем происходит сближение парных зачатков, образуется единая сердечная трубка, фиксированная на двух брыжейках — 3 неделя эмбриогенеза. В ней выделяют: венозный синус (самая крупная часть зародышевого сердца), единое предсердие, единый желудочек и артериальный конус (рис.15).
Рис.16. Схема двухкамерного сердца снаружи.
Сердечная трубка растет неравномерно. Вначале образуется желудочковая петля. Предсердия и венозный синус смещаются вверх и краниально. Артериальный конус (краниальный конец трубки) опускается вперед и вниз (рис.15).
На 5-8-й неделе внутриутробного развития образуются перегородки сердца. Первичная межпредсердная перегородка растет изнутри от задней стенки предсердия вниз к эндокардиальным подушкам, расположенным между предсердием и желудочком. Первичная перегородка существует недолго, затем она прорывается и остается в виде «клапана», направляющего кровь из правого предсердия в левое. Вторичная межпредсердная перегородка растет в том же направлении, но смещена вправо и имеет овальное отверстие, через которое кровь свободно попадает из правого предсердия в левое. В норме после рождения, когда включается легочное кровообращение и повышается давление крови в левом предсердии, верхние края первичной и вторичной перегородок сближаются и закрывают овальное отверстие (как правило, через 2-3 недели после рождения). Со стороны правого предсердия на месте отверстия остается овальная ямка, окруженная плотным краем. Артериальный ствол разделяется аорто-легочной перегородкой на аорту и легочный ствол. Она растет снизу вверх. При этом ствол совершает спиральное вращение по направлению часовой стрелки на 225°. Четыре эндокардиальные подушки на границе желудочка и артериального конуса преобразуются в полулунные клапаны аорты и легочного ствола.
На 8-й неделе развития на вершине межжелудочковой петли образуется продольная борозда, а изнутри — полулунная складка, которая растет внутрь и вверх к эндокардиальным подушкам предсердно-желудочкового канала. В этом месте происходит соединение мышечной и перепончатой частей межжелудочковой перегородки. К 8-й неделе внутриутробного развития сердце имеет 4 камеры.
Рассматриваемый вариант развития двухкамерного сердца пациентки нам представляется в следующем виде (рис.16, рис.17). Совершенно определенно не завершились полностью многие этапы формирования камер сердца. Частично развилась только мышечная часть межжелудочковой перегородки, которая имеет вид двух листков и составляет около половины размера и структуры таковой в норме. Оба предсердия не разделились перегородкой и функционируют как единая камера. Обобщенные предсердия и желудочки разделены единым атрио-вентрикулярным клапаном (рис.17).
В связи с этим вариантом строения и функционирования сердца представляют большой интерес несколько вопросов: почему на этапе формирования межпредсердной и межжелудочковой перегородок остановилось развитие камер сердца? Каков этиологический фактор нарушения эмбриогенеза? Неясна динамика данного порока в постнатальный период. Какие механизмы обеспечили компенсированную жизнедеятельность организма пациентки на протяжении 20 лет?
В практике случай столь длительного существования такого порока уникально редок. По данным многих авторов, дети с подобным пороком не доживают до года. Литературных фактов функционирования двухкамерного сердца в течение вот уже двадцати лет не встречается.
На основании приведенных наблюдений и обсуждений нами предложена следующая формулировка окончательного диагноза для описанного клинического случая:
- Основное заболевание: врожденный порок сердца недифференцированного типа: единственный правый желудочек с рудиментарным левым; гипоплазия межжелудочковой перегородки; атрезия митрального клапана; общее предсердие, общий атриовентрикулярный клапан. Относительный стеноз аортального клапана 1 степени;
- Осложнения основного заболевания: ХСН I-IIA ст. ФК 1-2, stage «C» АСС\АНА 02-05. Дыхательная недостаточность III ст. Легочная гипертензия III ст.;
- Сопутствующие заболевания: дермоидная киста правого яичника.
Тактика оказания помощи больным с врожденным пороком сердца строится с учетом течения порока, эффективности консервативного лечения, возможности и риска проведения хирургического лечения. В данном случае после установления диагноза открытыми остаются вопросы: каков тип порока, возможна ли оперативная коррекция данного порока, сроки выполнения операции, возможность оперативного вмешательства по поводу дермоидной кисты правого яичника.
Нами были даны следующие рекомендации по ведению пациентки:
- тромбо-АСС 1 раз в сутки после еды постоянно;
- капотен 12,5 мг 1 раз в сутки утром после еды, постоянно;
- беталок — ЗОК 6,75 мг (1\4 от 25 мг) 1 раз в сутки, утром после еды, постоянно;
- эйконол (или омеганол или омега-3) 450 мг 1-2 раза в день, постоянно;
- курсы: эссенциале по 1-2 капс 2-3 раза в день 2 месяца в полгода;
- пентавит по 2 табл 2-3 раза в день 2 месяца в полгода; фолиевая кислота по 1 мг 1 раз в день 2 мес в год;
- витамин Е по 200 мг 1 раз в день 2 месяца в году.
Именно в подобных клинических ситуациях весьма актуальна первичная профилактика инфекционного эндокардита: азитромицин 500 мг за 1 час однократно или клиндамицин 600 мг за 1 час или амоксициллин 2 г за 1 час.
Пациентке рекомендовано проходить обследование 1 раз в полгода с проведением: 1) рентгенографии органов грудной полости в двух проекциях; 2) ЭКГ; 3) ЭХО-КГ; ЧП-ЭХО-КГ; 4) суточный мониторинг ЭКГ; 5) клинический анализ крови; 6) общий анализ мочи. Один раз в год необходим контроль агрегограммы; определение уровня натрий-уретического пептида в крови. Рекомендована консультация клинического генетика и МРТ-трехмерная реконструкция сердца.
Литература:
1. Беклемишев В. Н. Основы сравнительной анатомии беспозвоночных, 3 изд., т. 2, М., 1964.
2. Гайворонский И. В. Нормальная анатомия человека. Т. 1, 4-е изд. СПб.: Специальная литература, 2004.
3. Шабалов Н. П. Неонатология — учебник для студентов, интернов и резидентов педиатрических факультетов медицинских институтов. СПб.: Специальная литература, 1995.
4. Шмальгаузен И. И. Основы сравнительной анатомии позвоночных животных, 4 изд. М., 1947.
5. Наследственная патология человека, руководство в 2-х томах. Под ред. Вельтищева Ю. Е., Бочкова Н. П. М., 1992.
6. Burggren, W. W. (1988), «Cardiac Design in Lower Vertebrates: What Can Phylogeny Reveal About Ontogeny?» Experientia, 44:919-930.
7. Randall, D.J. (1968), «Functional Morphology of Heart in Fishes,» American Zoology, 8:179-189.
8. Kardong, K. V. (2002), Vertebrates: Comparative Anatomy, Function, Evolution (Boston, MA: McGrawHill).
9. H. B. Taussig, Congenital Malformations of the Heart, Harvard University Press, Cambridge, 2nd ed., 1960.
Источник: Обрезан А.Г., Стрельников А.А., Дерюгин М.В., Гриненко А.А., Андреевский С.Д., Воеводина А.А., Пуцелик И.В. Двухкамерное сердце // Журнал "Медицина XXI век № 5 {6} 2007" с. 94-100